Analyse van energiesystemen
Deze website vormt het eerste deel van het webdictaat voor het vak TB142E Analyse van energiesystemen, behorende bij de opleiding Technische Bestuurskunde aan de TU Delft, in het collegejaar 2023-2024. Dit webdictaat kan het beste worden bekeken met de browsers Chrome, Safari en evt. (afhankelijk van het besturingssysteem) ook Firefox. Deel 2 van het webdictaat, over de lesstof voor deel 2 van het vak, volgt zsm.
Het dictaat kan op meerdere manieren worden bestudeerd:
• per college: in het menu links staat een overzicht van het dictaat ingedeeld per college. Voor elk college staat daar een link naar de beginpagina van dat college en een overzicht met de pagina's van het webdictaat die relevant zijn voor het betreffende college.
• alles op één pagina: er is een printbare versie waarin alle pagina's in collegevolgorde zijn opgenomen.
• naar eigen inzicht: links in het menu is een zoekfunctie.
Voor contactinformatie en referenties, zie het colofon.
Voor meer informatie over dit vak:
Brightspacew
Studiegidsw
Op- en aanmerkingen zijn van harte welkom: l.stougie@tudelft.nl.
Heel veel plezier en succes met het bestuderen van het webdictaat.
Met vriendelijke groet,
Lydia Stougie, modulemanager.
Colofon
Dit webdictaat is een bewerking van en uitbreiding op het dictaat TB142Ea, Analyse van Energiesystemen, versie 1.0, studiejaar 2013-2014, geschreven door Gerard P.J. Dijkema en Émile J.L. Chappin.
Editor:
dr.ir. Lydia Stougie
Contactinformatie: l.stougie@tudelft.nl.
Auteurs:
dr.ir. Lydia Stougie
dr.ir. Gerard P.J. Dijkema
dr.ir. Émile J.L. Chappin
Copyright © 2024 TU Delft, L. Stougie (ed.) en de auteurs. Tenzij anders vermeld is alles in deze publicatie gelicenseerd onder een Creative Commons Naamsvermelding GelijkDelen 4.0. Kijk op deze licentiepaginaw voor een volledige tekst van de licentie.

Refereren
Algemene referentie:Stougie, L. (ed.) (2024) Webdictaat Analyse van energiesystemen, http://eduweb.eeni.tbm.tudelft.nl/TB142E.
Referentie naar een specifieke pagina:
Paginatitel, in: Stougie, L. (ed.) (2024) Webdictaat Analyse van energiesystemen, http://eduweb.eeni.tbm.tudelft.nl/TB142E/pagina.
Disclaimer
Hoewel de auteurs van dit webdictaat de uiterste zorgvuldigheid hebben betracht, aanvaarden de auteurs en de uitgever geen enkele aansprakelijkheid voor eventuele fouten en onvolkomenheden, noch voor de gevolgen daarvan.Pagina's in collegevolgorde
In onderstaande tabel staan de beginpagina's voor de colleges in het collegejaar 2023-2024, onder voorbehoud van wijzigingen.
| Week | maandag | dinsdag | woensdag | donderdag | vrijdag |
| 1 | Introductie energiesystemen | Thermische centrales | |||
| 2 | Werkcollege | Energie en energieconversie | |||
| 3 | Toestandsgrootheden en reacties | Werkcollege | |||
| 4 | Energiesysteemanalyse | Werkcollege | |||
| 5 | Pinksteren | Tentamen 1 (wk 1-5) | |||
| 6 | Kerncentrales | Luchtverontreiniging en hydrologische kringloop | |||
| 7 | Energiebalans aarde en koolstofkringloop | Werkcollege | |||
| 8 | Energieopslag | Levenscyclusanalyse | |||
| 9 | Werkcollege | Afronding en vooruitblik, Vragencollege | |||
| 10 | Tentamen 2 (wk 1-10), Hertentamen 1 | ||||
| +3 | Hertentamen 2 |
Week 1: Introductie energiesystemen
energiesystemenenergiesystemen-voorbeeld-elektriciteitsnet
systeembenadering-stappen
systeembenadering-voorbeeld-elektriciteitscentrale
systeembenadering-controle-eenheden
Week 1: Thermische centrales
thermische-centralesthermische-centrales-fossiele-grondstoffen
thermische-centrales-AVI
thermische-centrales-CSP
massabalans
massabalans-fabrieken
massabalans-verblijftijd
chemische-reacties
chemische-reacties-mol
chemische-reacties-moleculen
Week 2: Energie en energieconversie
energievormenenergiebehoudswet
energieconversie
energieconversie-voorbeeld-CV-installatie
energieconversie-warmte-elektriciteit
warmtecapaciteit
thermische-centrales-koeling
Week 3: Toestandsgrootheden en reacties
toestandsgroothedenenthalpie-reactie
enthalpie-reactie-LHV
enthalpie-wet-van-Hess
enthalpie-vorming
Week 4: Energiesysteemanalyse
energiesysteemanalyseenergiesysteemanalyse-voorbeeld-datahotel
energiesysteemanalyse-voorbeeld-ammoniakfabriek
energierendement
energierendement-WKC
energiesystemen-elektriciteitscentrale-alleen-stoomcyclus
energiesystemen-elektriciteitscentrale-met-gasturbine
Externe bronnen die onderdeel zijn van de leerstof
De externe bronnen die bij het tweede deel van de leerstof horen, worden later hier vermeld.
Introductie energiesystemen
Aan de basis van de analyse van een groot aantal TB-vraagstukken staat systeemdenken, cq. een systeembenadering. Staat in andere modules het systeem van netwerk van actoren en hoe die handelen centraal, in TB142E gaat het om de fysieke, technologische systemen voor de energievoorziening en om het natuurlijke systeem waarin wij leven, waaraan we grondstoffen onttrekken en afvalstoffen teruggeven.
De analyse van 'man-made' systemen en hun relatie met de omgeving - het natuurlijk milieu - wordt in TB142E in een geïntegreerde systeembenadering behandeld. Wat is nu die systeembenadering die zijn wortels heeft in de procestechnologie, toegepaste thermodynamica en systeemtheorie? Waarom is deze zo geschikt om kennis uit chemie, milieukunde en technologische systemen te integreren? En om techniek, bestuur en management in de opleiding TB en het onderzoek aan de faculteit TBM met elkaar te verbinden?
Voorbeelden van energiesystemen zijn:
• Een elektriciteitscentrale. Deze zet brandstof en lucht om in elektriciteit, rookgas en restwarmte. Elektriciteitscentrales zijn groot, het terrein van bijvoorbeeld de Eemscentrale in Groningen beslaat enkele hectares. Centrales staan op een vaste plek, en bestaan uit verschillende subsystemen, die weer opgebouwd zijn uit vele systeemelementen, apparaten, waar weer duizenden onderdelen in zitten.
• Het landelijke elektriciteitsnet waarvan een elektriciteitscentrale onderdeel is. Dat is een systeem met centrales, transformatorstations en hoogspanningsleidingen als systeemelementen. Op haar beurt maakt het Nederlandse elektriciteitsnet deel uit van het Europese netwerk - het is daarmee verbonden via zogenaamde interconnectoren.
• Aardgascentrales zijn aangesloten op het landelijke aardgasnet. Het elektriciteitsnet en haar systeemelementen zijn op verschillende manieren verbonden met de fysieke, natuurlijke omgeving: ze gebruiken lucht, en stoten rookgas uit; ze onttrekken koelwater en geven dat opgewarmd weer terug aan meer, rivier of Noordzee, of aan de atmosfeer als waterdamp dat de koeltoren verlaat. Terwijl dit lokale fysieke verbindingen met de omgeving zijn, kunnen de negatieve effecten zich op een ander, hoger schaal- of systeemniveau manifesteren. Het bekendste voorbeeld daarvan is ongetwijfeld de broeikaswerking van CO2 en daarmee samenhangende klimaatverandering. Zwaveluitstoot door centrales, in de vorm van SO2, en NOx veroorzaakt op continentale schaal zure regen, terwijl de uitstoot van roetdeeltjes lokaal en regionaal problemen veroorzaakt.
• Als een auto wordt volgetankt met benzine of diesel, dan wordt er een product gekocht dat voortgebracht is uit een keten van productieprocessen. De 'supply-chain' of voortbrengingsketen voor benzine begint bij de productie van ruwe olie en bestaat verder uit transport, raffinage en afmenging van het product, en distributie naar de tankstations. Verder zijn er systemen ingericht die olieplatforms voortbrengen, het daarvoor benodigde staal produceren etc.
Deze voorbeelden laten zien dat systemen gekenmerkt worden door verschillen in:
• schaalgrootte en systeemniveau
• technische karakteristiek en daaruit voortvloeiende prestatie
• interne complexiteit
• inputs en outputs
• type en functie
Bij een (energie)systeemanalyse kan een algemeen toepasbare procedure gevolgd worden, zie hiervoor de stappen van een (energie)systeembenadering.
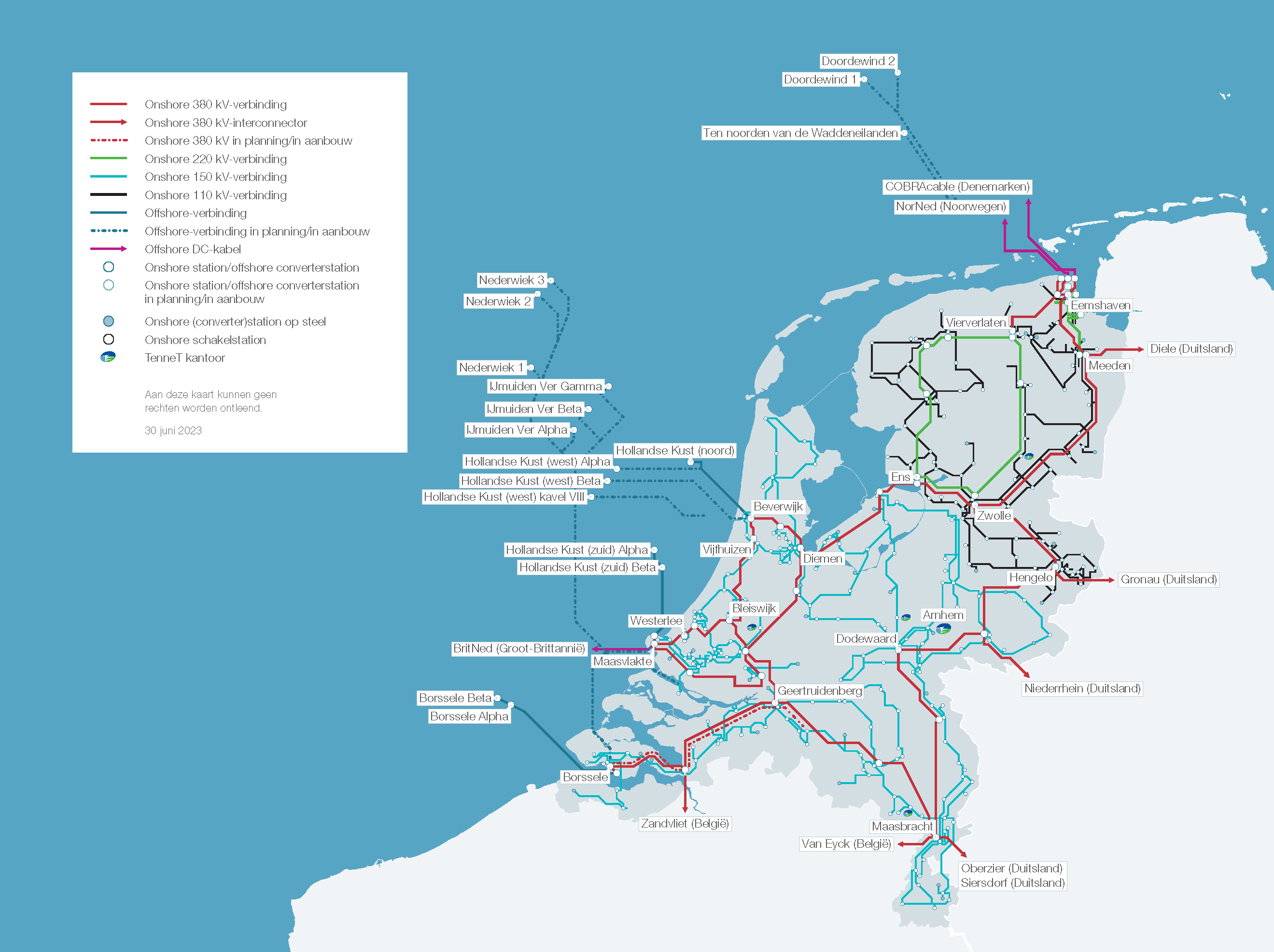
Voorbeeld van een energiesysteem: het Nederlands elektriciteitsnet
Het Nederlandse elektriciteitsnet verbindt gebruikers en producenten van elektriciteit. Als goed naar onderstaande figuur wordt gekeken dan kan het elektriciteitsnet als volgt systematisch in beeld worden gebracht.
• Als systeemgrens wordt de grens van Nederland gekozen.
• Het systeem elektriciteitsnet bestaat uit de systeemelementen:
- productie-eenheden:
1. grote elektriciteitscentrales
2. warmte-krachtcentrales
3. overig: afvalverbranders, windparken etc.
- hoogspanningsleidingen beheerd door TenneT, de landelijk netbeheerder van de 380 kV, 220 kV, 150 kV en 110 kV-netten
- eindgebruikers in Nederland: direct aangesloten op het hoogspanningsnet (industriële grootverbruikers) of aangesloten via regionale distributienetten
- interconnectoren waarmee het 380 kV-net is verbonden met het buitenland
- transformatorstations (380 → 220 kV etc.), maar die zijn niet weergegeven in de figuur
• Als het elektriciteitsnet als een fysiek systeem wordt beschouwd waarin centrales onderling en met eindgebruikers zijn verbonden, dan zijn het de verbindingen tussen systeemelementen die structuur aan het systeem geven. Deze hoogspanningsleidingen zijn zelf dus ook systeemelementen.
• Uit bovenstaande figuur kan opgemaakt worden dat de fysieke inputs van het systeem de diverse brandstoffen zijn (aardgas, biomassa, steenkool, uranium) en lucht. De fysieke (of materiële) outputs van het systeem zijn:
- elektriciteit getransporteerd naar de eindgebruikers en over de interconnectoren (bij eindgebruikers wordt de elektriciteit uiteindelijk bijna zonder uitzondering geheel omgezet in restwarmte)
- rookgas met daarin: H2O, CO2, NOx (aardgas, biomassa, steenkool), SO2 en roetdeeltjes (biomassa, steenkool)
- vaste restproducten: bodemas en vliegas, gips (steenkool) en kernafval (kerncentrale)
- warmte die in de centrales wordt weggekoeld met koelwater
• De genoemde inputs en outputs vormen tevens de verbinding tussen het elektriciteitsnet en haar omgeving: er worden brandstoffen aan de aardkorst onttrokken, lucht wordt ingezogen vanuit de atmosfeer en de massa na verbranding wordt als rookgas teruggeven aan de atmosfeer, c.q. opgevangen voor transport naar deponie of hergebruik (o.a. productie van gipsplaten uit rookgasontzwavelingsgips).
• Het systeem waarin de energie-inhoud van de brandstoffen wordt vrijgemaakt, omgezet in elektriciteit en getransporteerd naar de gebruiker kent vier energie-interfaces (outputs) met haar omgeving: energie die de gebruiker bereikt als elektriciteit, energie afgegeven aan het rookgas van de centrales (m.u.v. kerncentrales, zonnepanelen, windturbines), energie afgegeven aan het koelwater van centrales, en elektriciteit die in de hoogspanningsleidingen wordt omgezet in warmte en afgegeven aan de omgeving (netverliezen).
Stappen van een (energie)systeembenadering
Een algemeen toepasbare procedure, die voortborduurt op het stappenplan onderwezen tijdens TB141E, is de volgende:
1. Systeembeschrijving en systeemdiagram
a. Inventariseer de beschikbare informatie in de systeembeschrijving en denk na over het gevraagde. Relateer het vraagstuk aan de inhoudskennis opgedaan in het vak en maak een eerste keuze voor de systeemdecompositie(mogelijkheden):
- géén verdere decompositie, het systeem wordt beschouwd als black-box,
- eerste opdeling in systeemelementen.
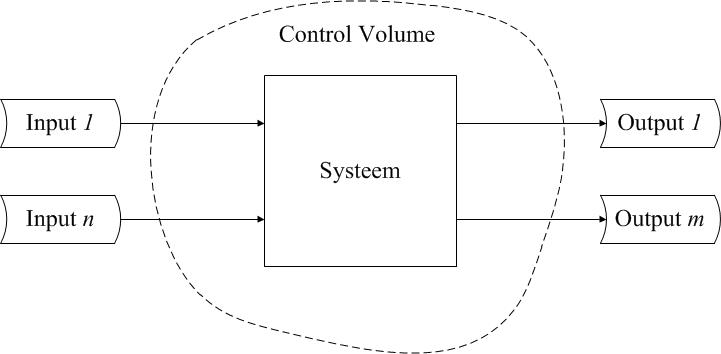
b. Teken, op basis van stap 1a, een (voorlopig) systeemdiagram. Dit is een schematische weergave van het systeem in kwestie dat geschikt is voor het beantwoorden van het gevraagde. In een bruikbaar systeemdiagram is:
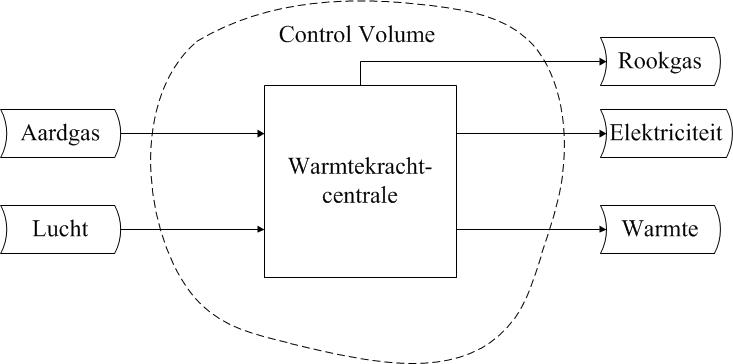
- een zinvolle keuze gemaakt voor de systeemgrens die ook is weergegeven. Daarnaast is de functie (naam) van het systeem vermeld. De systeemgrens bepaalt eveneens het control volume dat gehanteerd wordt voor de analyse (zie onderstaande figuur).
- de beschikbare informatie over alle in- en uitgaande stromen verwerkt, dus zowel de massa- als de energiestromen: deze passeren de systeemgrens;
- ten slotte is indien nodig het systeem verdeeld in onderdelen, systeemelementen of subsystemen.
2. Eerste schatting antwoord. Bepaal naar welke grootheden gevraagd wordt en kies daarbij eenheden. Schat de ordegrootte van de gevraagde grootheden.
3. Oplossingsstrategie. Formuleer een oplossingsstrategie en maak daarbij de benodigde aannames. Welke methoden zijn te gebruiken om de gevraagde grootheden te berekenen?
4. Berekening. Bereken het antwoord op de vraag nu volgens de in stap 3 gekozen strategie. Bij elke berekening dienen de eenheden (dimensies) voor en na het =-teken gelijk te zijn.
5. Controle. Controleer het antwoord. Voldoet het antwoord aan de verwachting, geschat bij stap 2? Voor het uitwerken van vraagstukken is het eerder regel dan uitzondering dat een of enkele iteratieslagen gemaakt worden waarbij delen van de uitwerking worden verbeterd zodat een betere oplossing wordt gevonden. De methode is immers gericht op het structureren van informatie en oplossing.
6. Beantwoording. Beantwoord het gevraagde met vermelding van berekening en eventuele aannames.
De systeembenadering kan bijvoorbeeld worden toegepast op een elektriciteitscentrale.
Toepassing systeembenadering op een elektriciteitscentrale
Het vraagstuk
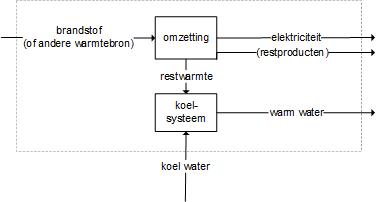
In de zomer van 2007 is 'Alarmfase Rood' in werking getreden voor de elektriciteitsvoorziening in Nederland. Een dreigend tekort aan productiecapaciteit zou tot regionale of zelfs landelijke storing en netuitval kunnen leiden. In de communiqués van TenneT, de landelijke netbeheerder, werd 'een gebrek aan koelcapaciteit' aangemerkt als oorzaak van de problemen.Watergekoelde elektriciteitscentrales kampten met een absoluut tekort aan koelwater door lage waterstanden én met een te hoge koelwaterinnametemperatuur door de extreme temperaturen. De koelwateruitlaattemperatuur is gelimiteerd op maximaal 30 °C; het temperatuurverschil tussen de koelwaterinlaat en -uitlaat moet minder dan 4 °C bedragen. De hoeveelheid energietoevoer (Q) nodig om 1 cm3 water precies 1 °C op te warmen is gelijk aan 1 Cal (4,2 J).
Zoals ook door de Minister van Economische Zaken is gesuggereerd, is de bouw van koeltorens bij de centrales een mogelijke oplossing ter voorkoming van elektriciteitstekorten in hete zomers. In koeltorens wordt ingenomen water bij ongeveer omgevingstemperatuur verdampt. De daarvoor benodigde verdampingsenergie is ongeveer 40 kJ/mol.
Vragen:
• Verklaar waardoor de hete zomer en de koelwaterrestricties leiden tot een verminderde elektriciteitsproductie. Betrek daarbij de eerste hoofdwet van de thermodynamica en de formule voor het Carnot-rendement, en maak geschikte aannames.
• Bereken een schatting van de hoeveelheid koelwater nodig voor het Nederlandse elektriciteitsproductiepark op een hete tropische dag in augustus. Op zo'n dag wordt gemiddeld over een etmaal een productievermogen van 8000 MW ingezet; het gemiddeld rendement van de stroomproductie is 45%. Bereken een schatting voor:
- een koelwaterinnametemperatuur van 20 °C
- een koelwaterinnametemperatuur van 28 °C
en zet de berekening bij voorkeur zo op dat (met een deel daarvan) ook onderstaande deelvragen beantwoord kunnen worden.
• Licht met een systeemdiagram het verschil tussen de inzet van koeltorens en koelwatersystemen toe.
• Hoeveel water zouden de Nederlandse centrales verdampen op een tropische dag, na installatie van koeltorens?
• Maak een schatting van het capaciteitsverlies van de centrales dat NIET wordt opgeheven door de installatie van koeltorens.
Toepassing van de systeembenadering
Stap 1a: SysteembeschrijvingDoor het gehele vraagstuk te lezen kunnen de betreffende beschrijving en de vragen gekoppeld worden aan de al aanwezige kennis. De contouren van een oplossingsstrategie kunnen zich al vormen. Dan is de eerste stap van de systeembenadering voltooid. Echter, door systematisch stap 1b en 2 uit te voeren wordt vermeden dat al vanaf het begin de verkeerde weg wordt ingeslagen, dan wel dat zaken over het hoofd worden gezien. Dit vereist oefening!
Stap 1b: Systeemdiagram
Er wordt een systeemdiagram gemaakt waarmee in dit geval de energiestromen rond de centrale inzichtelijk worden gemaakt.
• Kies een zinvolle systeemgrens. De systeemgrens wordt gestreept weergegeven indien er sprake is van een open systeem: een systeem dat verbinding heeft met zijn omgeving en dus in- en uitgaande stromen heeft. De systeemgrens geeft hier het terrein van de elektriciteitscentrale weer. Geef van een systeemgrens altijd aan waar die zich bevindt (en wat wel en niet binnen het systeem gerekend wordt). En vermeld de functie (naam) van het systeem.
• Inventariseer alle stromen. In het diagram worden de in- en uitgaande massa- en energiestromen weergegeven door pijlen. Deze moeten altijd worden benoemd. Combineer de gegeven beschrijving en de kennis opgedaan in het vak om na te gaan of er stromen zijn die niet genoemd zijn. Neem deze alsnog op, of maak geschikte aanname(s).
Hoewel een systeemdiagram eenvoudig lijkt, geeft het het nodige overzicht en biedt het veelal inzicht, nodig voor correcte oplossing van vraagstukken uit het domein. Het zelf tekenen van bruikbare diagrammen is niet moeilijk maar vereist wél zelfwerkendheid. Een zekere mate van orde en netheid is gewenst. Meestal volstaat een schema op 'de achterkant van een envelop'. In Angelsaksische engineering curricula wordt van studenten geëist dat ze zgn. 'back-of-the-envelope' berekeningen kunnen maken: met behulp van relatief eenvoudige methoden en hulpmiddelen de essentie van een probleem weergeven en een eerste geschatte oplossing geven. Dat wil dus zeggen: zonder het gebruik van ICT-tools, simulatiemodellen, spreadsheets enz.! Dit is eveneens een van de leerdoelen van TB142E.
Het systeemdiagram voor deze vraag is weergegeven in onderstaande figuur. Het is een vereenvoudigde schematische weergave van een elektriciteitscentrale en kan van pas komen bij de uitwerking van de hierboven gestelde vragen over de elektriciteitscentrale. Hoewel het niet altijd expliciet gevraagd wordt, is het verstandig om altijd een diagram te tekenen. Het tekenen van een diagram dwingt tot gestructureerd denken en geeft overzicht.
Stap 2: Eerste schatting antwoord
Eerst wordt een ruwe schatting gemaakt van het antwoord of tenminste van de verwachte ordegrootte (bijvoorbeeld 30-70% rendement). Dit kan een zeer ruwe schatting zijn, maar door deze schatting te maken kunnen ernstige fouten worden voorkomen.
Stap 3: Oplossingsstrategie
Als een systeemdiagram bekend is, komt de strategie vaak al snel in beeld. Bij de beantwoording van de vraag zal gebruik moeten worden gemaakt van massa- en energiebalansen.
Stap 4: Berekening
Door de opgedane kennis te combineren met de theorie over massa- en energiebalansen kunnen de gevraagde antwoorden worden berekend. Om de vragen afdoende te kunnen beantwoorden is het noodzakelijk veel te oefenen. Daarvoor worden binnen het vak voldoende mogelijkheden geboden.
Stap 5: Controle
Nadat een antwoord is gevonden wordt dit in deze stap vergeleken met de eerdere schatting. Indien er een grote afwijking wordt gevonden, kan bijv. door de eenheden (dimensies) van de berekening te controleren gezocht worden naar de fout. Wordt de fout niet gevonden, merk dan in ieder geval op dat het antwoord niet kan kloppen om aan te geven dat bekend is waarover gesproken wordt en dat er niet zomaar een sommetje wordt opgelost. Waar nodig worden iteratieslagen gemaakt om het antwoord verder te verbeteren.
Voorbeeld van controle van de eenheden (dimensies)
Alhoewel dit taalkundig eigenlijk niet juist is, zijn voor de duidelijkheid alle eenheden in dit voorbeeld tussen vierkante haken gezet.
Vraag: Hoeveel energie levert een continu vermogen van 1,00 [GW] op in [GJ/dag]?
Antwoord:
E = P · τ
P = 1,00 [GW] = 1,00 [GJ/s]
τ = 1 [dag]
E = 1,00 [GJ/s] · 3600 [s/uur] · 24 [uur/dag] = 1,00 · 3600 · 24 · [GJ/s] · [s/uur] · [uur/dag] = 8,64 · 104 [GJ/dag]
en in Joules per dag zou dit zijn:
E = 8,64 · 104 [GJ/dag] · 109 [J/GJ] = 8,64 · 1013 [J/dag]
De eenheid van het antwoord klopt met de vraag. De dagelijkse energiehoeveelheid heeft de eenheid [GJ/dag].
Let op het gebruik van de voorvoegsels M(ega), G(iga) en T(era): door deze te gebruiken kan de berekening in 'engineering' units worden opgeschreven. Bij analyse en ontwerp van industriële systemen en energiesystemen wordt in de praktijk bijna altijd gebruik gemaakt van 'engineering units', getallen uitgeschreven als bijvoorbeeld 1,23 · 10a, waarin a een veelvoud is van 3. Daarmee wordt gevoel gehouden voor de ordegrootte (duizenden, miljoenen, miljarden etc.) en worden vergissingen voorkomen.
Indien de eenheden links en rechts van het gelijkteken niet overeenkomen, kan het zijn dat:
• er een verkeerde formule is gebruikt,
• een formule verkeerd is gebruikt,
• in de uiteindelijke berekening een gegeven niet of verkeerd is opgeschreven.
Thermische centrales
Thermische centrales zijn elektriciteitscentrales die elektriciteit genereren uit warmte. Deze warmte kan op verschillende manieren geproduceerd worden. Een bekende, maar steeds minder toegepaste, manier is de verbranding van fossiele grondstoffen zoals steenkool of aardgas. Kerncentrales behoren ook tot de thermische centrales. Hetzelfde geldt voor elektriciteitscentrales die biomassa of afval (in een afvalverbrandingsinstallatie) verbranden. Of het gaat bijvoorbeeld om zonnewarmte die opgevangen wordt in zonthermische installaties of aardwarmte van voldoende hoge temperatuur.
Bij het vak TB142E wordt ingegaan op de inrichting, werking en analyse van diverse thermische centrales, zoals aardgascentrales, warmtekrachtcentrales (WKC), kerncentrales, zonthermische centrales (Concentrated Solar Power, CSP) en afvalverbrandingsinstallaties (waste-to-energy).
Bij thermische centrales wordt vaak gesproken over het thermisch vermogen van zo'n installatie. Met het thermisch vermogen wordt de hoeveelheid warmtetoevoer bedoeld waarop de installatie ontworpen is. Deze warmtetoevoer is de hoeveelheid warmte die per tijdseenheid vrij zou komen als de toegevoerde brandstof verbrand wordt, m.a.w.: het thermisch vermogen van een installatie is de hoeveelheid brandstof die per tijdseenheid door deze installatie verwerkt wordt maal de stookwaarde van deze brandstof.
Bij het rekenen aan thermische centrales wordt vaak gebruik gemaakt van massabalansen. Ook moet rekening worden gehouden met de chemische reacties die optreden in een thermische centrale.
Fossiele grondstoffen
Fossiele grondstoffen zijn zonder uitzondering mengsels van koolwaterstoffen; ze bevatten zeer veel verschillende organische verbindingen:
• aardgas bestaat hoofdzakelijk uit methaan, maar bevat vaak ook organische verbindingen zoals ethaan, propaan, en anorganische verbindingen zoals zwavelwaterstof (H2S).
• aardolie is een mengsel van tot wel 100.000 verschillende organische verbindingen, van propaan en butaan tot iso-octaan en van benzeen tot zeer complexe organische verbindingen.
• steenkool bevat eveneens zeer veel verschillende organische verbindingen. Typerend voor steenkool is een hoge C/H-verhouding (tot wel 1:0,5).
Wereldwijd worden uit fossiele grondstoffen op grote schaal motorbrandstoffen en zuivere koolwaterstoffen geproduceerd:
• benzine bestaat uit een mengsel van onder andere butaan, pentaan, iso-heptaan, iso-octaan, iso-nonaan, benzeen, tolueen, etc.,
• diesel bestaat uit hogere alkanen, alkenen en aromaten, vanaf dodecaan tot C20, xyleen, naftaleen etc.,
• uit nafta (ruwe benzine) wordt zuiver etheen (ethyleen) en propeen (propyleen) geproduceerd, de bouwsteen van polyetheen (polyethyleen, PE) en polypropeen (polypropyleen, PP),
• uit aardgas wordt methanol geproduceerd, dat zijn weg vindt naar vele toepassingen.
Er zijn veel organische verbindingen die zuurstof (O) bevatten en op grote schaal industrieel worden geproduceerd, zoals methanol (methyl-alcohol, CH3OH), ethanol (alcohol, C2H5OH) en methyl-tert-butyl-ether (MTBE). Ook zijn er veel organische verbindingen met stikstof (N), bijvoorbeeld acrylonitril. De industriële productie van organische verbindingen wordt uitgebreid behandeld in het vak TB243E, Analyse van industriële systemen.
Afvalverbrandingsinstallatie
Een afvalverbrandingsinstallatie (AVI) verbrandt allerlei soorten afval en uit de ontstane warmte wordt op dezelfde manier als bij een conventionele centrale, d.w.z. via een stoomcyclus, elektriciteit opgewekt. De ontstane rookgassen worden uitgebreid gereinigd.
Net als een warmtekrachtcentrale produceert een AVI zowel elektriciteit als warmte. De warmte van een AVI gaat naar omliggende gebouwen (woningen, kantoren, fabrieken). De niet-brandbare fractie van het afval wordt o.a. gebruikt als funderingsmateriaal bij de aanleg van wegen en verwerkt in asfalt.
Zonthermische centrales
Zonthermische centrales zijn vaak grootschalige installaties waarbij zonlicht met behulp van spiegels geconcentreerd wordt om water of een ander medium op te warmen. Dit zijn de Concentrated Solar Power centrales, kortweg CSP genoemd. De in een CSP geconcentreerde zonnewarmte wordt gebruikt in een klassieke stoomcyclus waarin de warmte wordt omgezet in elektriciteit en restwarmte (die dient te worden weggekoeld).
Er bestaan verschillende uitvoeringsvormen van CSP-installaties, in het vak TB242E, Processen in de energiesector, wordt hier verder op ingegaan. Een van deze uitvoeringsvormen is een zonnetoren. In een veld rond zo'n toren staan honderden tot duizenden spiegels opgesteld die het zonlicht naar de ontvanger op de toren weerkaatsen. Het ontvangende medium is bijvoorbeeld vloeibaar lithium (Li) dat zeer hoge temperaturen kan bereiken, tot boven de 2000 °C. Met de opgevangen warmte kan vervolgens een stoomcyclus worden aangedreven waarmee elektriciteit geproduceerd wordt. Wanneer de ontvanger als opslag van de warmte kan fungeren, kan daarmee ook (een deel van) de nacht worden overbrugd.
Massabalans
Een massa- (of energie)balans wordt opgezet voor een systeem. De "wet van behoud van massa" zegt dat, behoudens atoomkernreacties, de totale hoeveelheid massa gelijk blijft. De hoeveelheid massa die een systeem ingaat minus de hoeveelheid massa die een systeem verlaat is dus gelijk aan de verandering in massa van het systeem, in formulevorm:$$ \Σφ_{\m,\in(i)} − \Σφ_{\m,\uit(j)} = {\d M_{\systeem}}/{\d t} $$
met:
$φ_{\m,\in(i)}$ = ingaande massastroom $i$ [kg/s]
$M_{\systeem}$ = massainhoud systeem [kg]
Massabalans bij open en gesloten systemen
Het opstellen van een balans levert informatie op over een systeem en haar relatie met de omgeving. Dit is slechts mogelijk omdat een systeem alléén gedefinieerd kan worden in relatie tot het universum, m.a.w.: een systeem is een door de gekozen systeemgrens afgezonderd deel van dat Universum.Als gekeken wordt naar de relatie van systeem met haar omgeving zijn er vier typen systemen te onderscheiden:
• gesloten systeem: géén inputs, géén outputs
• open systeem: inputs en outputs
• systeem met slechts inputs
• systeem met slechts outputs
In gesloten systemen is de hoeveelheid massa constant. Een gesloten vat waarin twee reactanten worden gemengd waarna deze wordt afgesloten, is te beschouwen als een gesloten systeem. Na verloop van tijd (de reactietijd) zullen de reactanten volledig gemengd zijn en wellicht (deels) gereageerd hebben tot producten. Omdat het systeem gesloten is, blijft de massa constant.
De twee laatste typen systemen zijn speciale gevallen van open systemen. Als een systeem slechts massa-inputs heeft, dan treedt er onvermijdelijk accumulatie van massa op in het systeem. Denk bijvoorbeeld aan de koeltank van een melkveehouder; deze wordt gedurende drie dagen telkens gevuld met melk afkomstig van de koeien.
Als een systeem slechts outputs heeft, dan vindt er de-accumulatie of depletie van het systeem plaats. Als de koeltank (bijna) vol is, dan wordt ze in korte tijd geleegd door aansluiting op een koeltankwagen van de zuivelcoöperatie. Een aardgasveld dat in productie is gebracht, is gedurende de gebruikstijd een systeem met slechts één output - het geproduceerde ruwe aardgas.
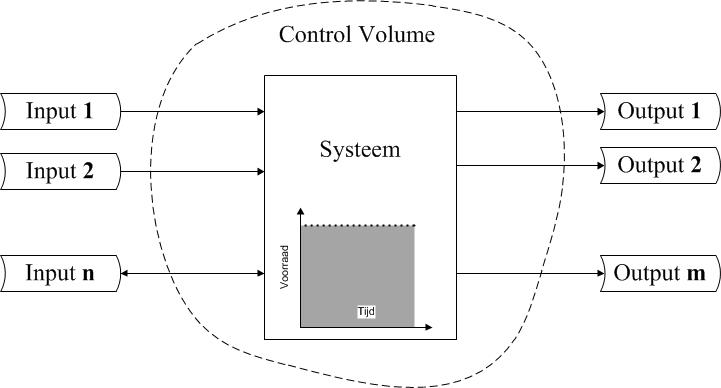
Stationaire systemen
Als er géén verandering van de stromen van een continu werkend systeem optreedt, ΔMsysteem = 0, dan wordt gesproken van een stationair systeem. Voor een open systeem met inputs en outputs treedt dan géén netto accumulatie of depletie op. Dit is schematisch weergegeven in onderstaande figuur.De vergelijking voor de wet van behoud van massa voor een open systeem wordt dan een balansvergelijking:
$$ Σφ_{\m,\in(i)} = Σφ_{\m,\uit(j)} $$
De balansvergelijking zegt dat voor een stationair werkend open systeem de som van de ingaande massastromen gelijk moet zijn aan de som van de uitgaande massastromen.
Voor de uitvoering van een systeemanalyse is deze vergelijking bijzonder handig. Door in de analyse te veronderstellen dat het gaat om een stationair systeem, is het mogelijk ontbrekende informatie af te leiden. Ook kunnen aangeleverde gegevens gecontroleerd worden op juistheid en consistentie.
Tot nu toe is er gesproken over systemen en massabalansen in het algemeen. Alles is een systeem impliceert dat een en ander van toepassing is op grote en kleine systemen, op elk schaalniveau.
De aarde is te zien als een gesloten systeem voor massa; er komt geen massa bij (behoudens meteoren/meteorieten). Ook verliest de aarde geen massa: de zwaartekracht is voldoende om te zorgen dat er via de atmosfeer geen massa verdwijnt naar het heelal. Het Centraal Bureau voor de Statistiek behandelt Nederland als een open systeem voor goederen (en geld). Zij stelt jaarlijks een fysieke en financiële handelsbalans voor Nederland op.
In elke chemische reactor geldt de wet van behoud van massa. Sterker, elke individuele chemische reactie is te beschouwen als een systeem: breng twee stoffen A en B bij elkaar en laat ze reageren tot C en D. De massa van A en B moet gelijk zijn aan de massa van C en D. Er kunnen balansen opgesteld worden voor herkenbare installaties of fabrieken, maar ook voor delen ervan. Er kan een balans worden opgesteld over een melkveehouderij, maar ook een balans over een klein stukje daarvan, de melktank. Om de CO2-uitstoot van een warmte-krachtcentrale te berekenen is het voldoende om de brander(s) in dat systeem te beschouwen, immers daar vindt de verbrandingsreactie plaats.
De massabalans kan bijvoorbeeld worden toegepast op fabrieken. Ook kan de massabalans gebruikt worden om de verblijftijd in een fabriek te berekenen.
Massabalans bij fabrieken
In de energiesector en de industrie bevinden zich veel fabrieken die continu produceren: er gaat voortdurend een aantal massastromen de fabriek in, terwijl er ook 24 uur per dag, 7 dagen in de week, producten en reststromen de fabriek verlaten. Een aantal voorbeelden daarvan met hun stromen zijn:• een pindakaasfabriek, waar continu pinda's, water, energie en (glas)verpakking wordt toegevoerd, en een continue stroom potten gevuld met pindakaas de fabriek verlaat.
• een elektriciteitscentrale gestookt op aardgas; de inputs zijn aardgas en lucht, de output (massa) is rookgas.
• een waterkrachtcentrale: zowel de (massa) input als de (massa) output is water.
• een afvalwaterzuiveringsinstallatie (awzi) die bijvoorbeeld het rioolwater van de regio Haaglanden verwerkt. De belangrijkste (massa)input is zuurstof (in lucht) voor de biologische afbraak, de outputs zijn CO2, effluent en zuiveringsslib.
Als er géén netto accumulatie of depletie in zo'n fabriek (in het continue systeem) optreedt, dan is deze te beschouwen als een open stationair systeem waarvoor de wet van behoud van massa en de balansvergelijking gelden. Voor de uitvoering van een systeemanalyse is deze vergelijking bijzonder handig. Door in de analyse van een fabriek te veronderstellen dat het gaat om een stationair systeem, is het mogelijk na inventarisatie van alle stromen ontbrekende of onbekende informatie af te leiden:
• Een pindakaasfabriek produceert dagelijks 100.000 potten pindakaas, met netto inhoud 700 g pindakaas. Bekend is dat de fabriek dagelijks slechts 60.000 kg pinda's verwerkt. De balansvergelijking vertelt hoeveel water, zout en suiker er bij de pindakaas wordt gemengd.
• Een moderne bierbrouwerij produceert 1 miljoen liter bier per dag. Het bedrijf gebruikt daarvoor dagelijks 6 miljoen liter water. Hieruit is direct duidelijk dat zo'n brouwerij dagelijks 5 miljoen liter afvalwater genereert.
• Een moderne 1000 MW aardgascentrales stookt zo'n 33,3 kg/s methaan (CH4) met 600 kg/s lucht. Uit de schoorsteen verdwijnt dan onvermijdelijk 633,3 kg/s rookgas(*).
• de awzi's in de regio Haaglanden hebben een zuiveringsrendement van 90%. Dat betekent dat het effluent het equivalent van 10% van de vuillast van de 1,5 miljoen inwoners in de Noordzee loost.
Uit deze voorbeelden blijkt dat het met een systeembenadering en kwantitatieve gegevens van een massabalans mogelijk is om relatief eenvoudig een idee te krijgen van de fysieke omvang van de stromen en daarmee de operatie van dergelijke fabrieken.
(*) Onderbouwing: het rendement van de modernste aardgascentrale in Nederland, de Máximacentrale in Flevoland, is 60%. Het thermisch vermogen van zo'n centrale is dus 1000 / 0,6 = 1667 MW. De stookwaarde (LHV) van methaan (aardgas) is ongeveer 50 MJ/kg; er is dus ca. 1667/50 = 33,3 kg/s methaan nodig. Een mol methaan wordt verbrand met 2 mol zuurstof. In lucht zit per mol zuurstof ongeveer 4 mol stikstof. Dat betekent dat voor elke 16 g methaan er 2 · 32 g zuurstof en 8 · 28 g stikstof wordt toegevoerd. Dat is dus (2 · 32 + 8 · 28) / 16 = 18 gram lucht per gram methaan. Dus bij 33,3 kg/s methaan hoort (stoichiometrisch) 33,3 · 18 = 600 kg/s lucht.
Verblijftijd
Een continu, stationair werkend systeem is in balans: de totale hoeveelheid massa die het systeem in gaat is gelijk aan de totale hoeveelheid massa die het systeem verlaat. Het gaat hierbij om de som van de massastromen Σφm, bijvoorbeeld 11,6 kg/s, wat gelijk staat aan 1000 ton/dag.
Voor een stationair systeem geldt dat de totale massastroom Σφm (kg/s of ton/dag) constant is. Tevens geldt dat de accumulatie ΔM gelijk is aan nul, ofwel de hoeveelheid massa M (kg) die in het systeem verblijft is constant.
Elk stationair systeem kan gekarakteriseerd worden met een verblijftijd θ (s). Er geldt:
$$ θ = {M_{\systeem}}/{Σφ_{\m,\in(i)}} = {M_{\systeem}}/{Σφ_{\m,\uit(j)}} $$
Is de totale massastroom 1000 ton/dag en de stationaire hoeveelheid massa in het systeem 1000 ton, dan is de verblijftijd θ gelijk aan één dag. Is de stationaire massa 11,6 kg, dan is de verblijftijd slechts één seconde.
Ook deze vergelijking kan weer omgekeerd gebruikt worden: als bekend is wat de doorstroom van een systeem en de verblijftijd zijn, dan is de massa of de stationaire voorraad in het systeem eenvoudig te berekenen.
De verblijftijd geeft een eerste indicatie hoe snel een systeem zal reageren op verstoringen. Als de verstoring te groot en te snel is dan kan het systeem te gronde gaan. Anderzijds kunnen systemen met een grote inhoud meestal wel tegen een stootje. Moderne productiesystemen bestaan uit zeer veel subsystemen en systeemelementen, die elk meestal een verschillende verblijftijd hebben. Als de spreiding in verblijftijden groot is, kunnen kleine verstoringen op de delen die een kleine verblijftijd hebben toch grote productie-eenheden ontregelen of zelfs lamleggen. Vaak is het onvermijdelijk dat verblijftijden verschillen of wordt er (bijvoorbeeld uit financiële overwegingen) voor gekozen.
In veel fabrieken worden de massastromen verwarmd met stoom, die veelal wordt geproduceerd in een warmte-krachtcentrale (WKC). Meestal wordt er voor gekozen om dit stoomsysteem een capaciteit te geven afgestemd op de continue verwarmingsbehoefte van de fabriek. Echter, als de fabriek heeft stilgestaan, is vaak veel warmte nodig om de gehele installatie en alle grondstoffen en tussenproducten op temperatuur te brengen. Andersom kan het voorkomen dat delen van een fabriek niet onder een bepaalde temperatuur mogen komen doordat dan bijvoorbeeld stolling van een reactiemengel optreedt. Vanwege de hoge kosten van een stoomsysteem met grotere capaciteit (grotere WKC, grotere leidingen etc.) kan dan bijvoorbeeld voor een slim gekozen en geplaatst (en relatief goedkope) bufferopslag in de fabriek gekozen worden.
Chemische reacties
Bij de analyse van energiesystemen moet rekening worden gehouden met optredende chemische reacties. Tijdens deze reacties reageren atomen en/of moleculen met zichzelf of met elkaar tot andere moleculen. N.B.: tijdens chemische reacties veranderen de atoomkernen niet! De isotopen van een element gedragen zich chemisch precies gelijk. Bijvoorbeeld:
H2 + 1/2 O2 → H2O
C2H4 + C2H4 → C4H8
Moleculen kunnen ook reageren tot (uiteenvallen in) hun samenstellende atomen. Bijvoorbeeld:
H2O → H2 + 1/2 O2
De samenstellende atomen blijven altijd de samenstellende atomen: in elke chemische reactie moet de elementenbalans voor elk element kloppen. Voor de algemene reactie:
nA + mB ⇔ pC + qD
moet dus voor alle soorten elementen gelden dat de som van het aantal atomen (respectievelijk C, O, H, N, S, Al, enz.) in stof A en B gelijk is aan de som van het aantal atomen (respertievelijk C, O, H, N, S, Al, enz.) in stof C en D.
Omdat atomen altijd in vaste verhoudingen aanwezig zijn in moleculen (wet van vaste verhoudingen) en omdat elk atoom een vast atoomgewicht heeft (uit te drukken in de atomaire massaeenheid u), zou aan chemische reacties gerekend kunnen worden in de eenheid u. Echter, omdat het in een chemisch laboratorium niet gemakkelijk is om een portie atomen of specifiek aantal moleculen af te meten, maar wél een hoeveelheid massa, zijn de begrippen mol en molmassa geïntroduceerd.
Reactiestoichiometrie
De verhouding waarin stoffen, moleculen, met elkaar reageren wordt de reactiestoichiometrie genoemd en wordt uitgedrukt als molverhouding.Voor de verbranding van zuiver methaan:
CH4 + 2 O2 → CO2 + 2 H2O
is de molverhouding CH4:O2 gelijk aan twee, terwijl de molverhouding CH4:CO2 gelijk aan één is. Er wordt in dit geval gezegd dat de reactiestoichiometrie CH4:O2 gelijk is aan 1:2.
Let op: doordat het molgewicht van CH4 16 g/mol en van CO2 44 g/mol is, is de massaverhouding CH4:CO2 in deze reactie 16:44 = 1:44/16 = 2,75. Bij de verbranding van elke ton zuiver methaan (CH4) ontstaat dus 2,75 ton kooldioxide (CO2).
De reactiestoichiometrie, kortweg stoichiometrie, en het feit dat van elke soort atomen het aantal links en rechts van de pijl gelijk moet zijn, kan gebruikt worden om:
• te controleren of een gegeven reactievergelijking klopt en om
• voor een gegeven reactie een kloppende reactievergelijking op te stellen.
Anders gezegd: de boekhouding van een chemische reactie moet kloppen.
De reactievergelijking C8H18 + 8 O2 → 8 CO2 + 8 H2O klopt overduidelijk niet. Octaan heeft 8 koolstofatomen. Die reageren inderdaad tot 8 CO2, maar octaan heeft per molecuul ook 18 waterstofatomen, die reageren tot 9 H2O en daarvoor is 4,5 (mol) O2 nodig. De kloppende reactievergelijking is dus: C8H18 + 12,5 O2 → 8 CO2 + 9 H2O.
Verbrandingsreacties betreffen veelal koolwaterstoffen. Bestaan deze uit alleen koolstof en waterstof, dan kan de volgende algemene vergelijking worden opgesteld voor de verbrandingsreactie:
CxHy + (x + y/4) O2 → x CO2 + y/2 H2O
Het werken met reactievergelijkingen is handig in systeemanalyse, omdat het niet uitmaakt in wat voor soort systeem de reactie plaatsvindt. Weliswaar is de uitvoering van de verbrandingsreactie van suiker in een menselijk lichaam heel anders dan wanneer suiker verbrand wordt in een oven, maar de reactievergelijking is hetzelfde. De volledige afbraak van organisch afval (bijvoorbeeld lozing van melasse) in een meer vraagt precies evenveel zuurstof als verbranding van dit organisch afval.
Overmaat en ondermaat
De begrippen overmaat en ondermaat zijn gerelateerd aan de reactiestoichiometrie.• Als voor een reactiemengsel de reactanten in precies de juiste (mol)verhouding aanwezig zijn, dan is er sprake van overmaat noch ondermaat. Bijvoorbeeld als de molverhouding CH4 en O2 gelijk is aan 1:2 dan is er overmaat noch ondermaat voor de verbrandingsreactie van methaan. De volledige verbranding van een brandstof met precies genoeg zuurstof wordt een stoichiometrische verbranding of een verbranding met de stoichiometrische hoeveelheid zuurstof genoemd.
• Is de verhouding echter gelijk aan 1:4, dan wordt gesproken van een overmaat zuurstof. Er is dan meer zuurstof aanwezig in het reactiemengsel dan nodig om de methaan geheel te verbranden. Als de reactie is verlopen, zal het productmengsel onvermijdelijk nog zuurstof bevatten.
• In hetzelfde geval, molverhouding CH4:O2 gelijk aan 1:4, wordt gesproken van een ondermaat methaan. Er is onvoldoende methaan aanwezig in het reactiemengsel om alle zuurstof weg te laten reageren.
In de industrie wordt veel gebruik gemaakt van overmaat cq. ondermaat om zo het verloop en de evenwichtsligging van reacties gunstig te beïnvloeden. Hierop wordt ingegaan in het vak TB243E, Analyse van industriële systemen.
Molbalansen
Zoals eerder behandeld, reageert methaan met zuurstof (uit lucht) tot kooldioxide en water:CH4 + 2 O2 → CO2 + 2 H2O
Dit is een kloppende reactievergelijking doordat de elementenbalans of molbalans voor zowel koolstof, waterstof als zuurstof klopt: het aantal atomen koolstof, waterstof en zuurstof links van de pijl is steeds gelijk aan het aantal rechts van de pijl. Hun combinatie, de moleculen waarin ze voorkomen, is veranderd door de reactie.
Om uit te kunnen rekenen hoeveel kilogram CO2 er per kilogram CH4 ontstaat, is het nodig om zo'n kloppende reactievergelijking te hebben en dat gerekend wordt met het molgewicht. In feite is het kloppend maken van een chemische reactievergelijking een probleem van lineaire algebra: een stelsel van lineaire vergelijkingen oplossen.
Voor verbrandingsreacties, reacties met koolwaterstoffen, is in het algemeen de vergelijking kloppend te maken door eerst te kijken naar de molbalans voor C (het aantal molen C links en rechts van de reactiepijl), vervolgens naar de molbalans van waterstof H en daarna zuurstof O.
Als bijvoorbeeld de belasting van een afvalwaterzuiveringsinstallatie (awzi) bekend is, m.a.w.: hoeveel organische stoffen er in een kubieke meter rioolwater zitten, hoeveel rioolwater de installatie verwerkt, dat het zuiveringsrendement bijvoorbeeld 90% is en wat de dagelijkse productie van zuiveringsslib is, dan kan met de kennis van afvalwaterzuivering een schatting gemaakt worden van de CO2-uitstoot. Er kan bijvoorbeeld aangenomen worden dat zuiveringsslib bestaat uit organisch materiaal (de netto groei aan biomassa van de micro-organismen die de organische vervuiling omzetten) en dat de rest van het organische materiaal door diezelfde micro-organismen wordt verbrand tot CO2 en water.
Mol en molmassa
Het begrip mol is gedefinieerd als het aantal atomen koolstof C in 12 gram 12C van dat materiaal, dus zuiver 12C. Dit is gelijk aan het getal van Avogadro :
NAvogadro = 6,022 · 1023 atomen/mol.
De molmassa van een atoom of molecuul is dan de massa van een mol atomen respectievelijk moleculen. NAvogadro koolstofatomen (zuiver 12C) hebben dus een molmassa van 12 g/mol.
Het begrip mol duidt dus een aantal aan en is daarmee te vergelijken met de begrippen 'dozijn' en 'gros'. Een dozijn computers is hetzelfde als 12 computers, een gros computers staat gelijk aan 144 computers en een mol computers betekent maar liefst een hoeveelheid van 6,022 · 1023 computers!
Elk element (C, Al, U etc.) heeft een unieke molmassa. De molmassa van zuurstofatomen is bijvoorbeeld 16 g/mol, dat van zuurstof O2 is daarmee 32 g/mol. Nota bene: voor (eerste orde) systeemanalyses wordt meestal de op 2 of 3 cijfers afgeronde molmassa gebruikt. Elke chemische stof (soort molecuul), zoals C2H6, C2H4 en H2O etc., heeft eveneens een unieke molmassa. De molmassa van een molecuul kan eenvoudigweg worden bepaald met behulp van de verhoudingsformule.
Een algemene formule voor de molmassa van koolwaterstoffen met verhoudingsformule CxHy is:
molmassaCxHy = x·molmassaC + y·molmassaH
Als van een stof niet precies bekend is uit welk molecuul of welke moleculen deze bestaat, kan vaak wél de verhoudingsformule bepaald worden. Uit deze verhoudingsformule kan dan een quasi-molmassa berekend worden, waaruit dan weer eigenschappen per massaeenheid (kilogram, ton) berekend kunnen worden. De verhoudingsformule van droge biomassa is bijvoorbeeld bij benadering CH2O. De quasi-molmassa is dus 30 g/mol.
Andersom vertegenwoordigt elke hoeveelheid massa van een stof ook een aantal molen. Bijvoorbeeld voor een kilogram aluminium (Al) geldt: 1 kg Al = 1000 g / 27 g/mol = 37 mol aluminium. Op dezelfde manier volgt uit de quasi-molmassa van biomassa dat een kilogram biomassa 33 (quasi-)molen bevat.
Het begrip mol is handig én noodzakelijk om te kunnen rekenen aan chemische reacties. Het impliceert dat niet alleen 2 atomen C met één molecuul O2 reageren tot 2 moleculen CO, maar ook dat 2 mol C met één mol O2 reageert tot 2 mol CO. Als de molmassa van elk afzonderlijk element bekend is, dan kan de massaverhouding van de benodigde reactanten en ontstane producten berekend worden. Deze informatie kan gehaald worden uit het Periodiek systeemw. Voor de vorming van koolmonoxide volgt dan eenvoudig dat 24 gram koolstof en 32 gram zuurstof reageren tot 56 gram koolmonoxide. Immers, volgens de reactievergelijking reageert 2 mol C met 1 mol O2 tot 2 mol CO, en de molmassa van koolstof (C) is gelijk aan 12 g/mol, dat van zuurstof (O2) is 32 g/mol, en koolmonoxide (CO) heeft een molmassa van 28 g/mol.
Het begrip mol stelt ook in staat de relatie te leggen tussen chemie en de inputs en outputs van industriële systemen, immers voor de laatste wordt zonder uitzondering met massa gerekend. De relatie tussen de inputs en outputs wordt echter vaak (mede)bepaald door de vaste verhoudingen waarin chemische reacties optreden.
Bij de voorbeelden van massabalansen bij fabrieken is het voorbeeld gegeven dat een moderne 1000 MW aardgascentrales zo'n 33,3 kg/s methaan met 600 kg/s lucht inneemt. De verbrandingsreactie van aardgas, methaan (CH4) suggereert dat methaan met zuurstof (uit lucht) reageert tot kooldioxide en water:
CH4 + 2 O2 → CO2 + H2O
De molmassa van methaan is ongeveer gelijk aan 1 · 12 + 4 · 1 = 16 g/mol. De molmassa van zuurstof is 2 · 16 = 32 g/mol. Als aardgas precies met de juiste hoeveelheid zuurstof wordt verbrand dan is volgens de vergelijking voor élke mol methaan 2 mol zuurstof nodig, dus voor elke 16 gram methaan is 2 · 32 = 64 gram zuurstof nodig. In een conventionele centrale wordt lucht gebruikt voor de verbranding. Naast zuurstof bevat lucht ook stikstof (lucht bevat bij benadering 21 vol.% zuurstof en 79 vol.% stikstof wat betekent dat, ervan uitgaande dat lucht zich gedraagt als een ideaal gas waardoor volumepercentage gelijk is aan molpercentage, lucht per mol zuurstof ook 79/21 mol stikstof bevat). Dat betekent dat voor elke 16 g CH4 er 2 · 32 g O2 en 79/21 · 2 · 28 g N2 wordt toegevoerd. Dat is dus: (2 · 32 + 79/21 · 2 · 28) / 16 = 17 g lucht per g methaan. Dus bij 33,3 kg/s CH4 hoort (stoichiometrisch) 33,3 · 17 = 566 kg/s lucht.
Atomen en moleculen
Voor het opstellen van balansen van processen waarin chemische reacties verlopen en voor het begrijpen van atoomkernreacties is het nodig iets te weten van de moderne basis van de chemie: atoomstructuur, moleculen en ionen. De moderne chemie gaat ervan uit dat materie is opgebouwd uit atomen, moleculen en ionen.
Voor het begrip van atomen en moleculen kan gekeken worden naar de volgende eenvoudige chemische reactie: de vorming van koolmonoxide (CO) uit koolstof (C) en zuurstof (O2). Koolstof (bijvoorbeeld in de vorm van grafiet) kan met zuurstof reageren tot koolmonoxide:
2C + O2 → 2 CO
Deze reactievergelijking introduceert een aantal fundamentele begrippen:
• atoom: atomen zijn de kleinste, chemisch ondeelbare bouwstenen van materie. Het zijn atomen koolstof en zuurstof die deelnemen aan de reactie tot koolmonoxide.
• molecuul: een molecuul is te definiëren als een geordende verzamelingen van atomen, bijeengehouden door (chemische) bindingen. Het molecuul zuurstof bestaat uit twee atomen zuurstof bijeengehouden door een (relatief sterke) chemische binding, waardoor zuurstof in de lucht relatief stabiel is en bestaat. Koolmonoxide bestaat uit een binding tussen koolstof en zuurstof.
• element: (chemische) elementen bestaan elk uit slechts één unieke soort atomen. Een zuivere hoeveelheid van elk element (bijvoorbeeld koolstof) bestaat slechts uit atomen van dat element (bijvoorbeeld koolstofatomen).
Ten slotte laat de reactievergelijking zien dat koolmonoxide, CO, bestaat uit koolstof C en zuurstof O in de vaste verhouding van 1:1. Zo'n vaste verhouding geldt niet alleen voor koolmonoxide, maar voor alle (zuivere) chemische verbindingen of moleculen.
Voor het opstellen van massa- en energiebalansen van systemen waarin chemische reacties plaatsvinden is het voldoende te weten dat elk molecuul niet anders is dan een geordende verzameling atomen, bijeengehouden door een chemische binding. Hoe en waarom die chemische binding werkt, en waarom sommige atomen binden met anderen, terwijl bijvoorbeeld edelgassen géén binding aangaan is het terrein van de (verklarende) chemie. Voor dit vak is het van belang te weten dat er moleculen bestaan, die elk opgebouwd zijn uit een vaste verzameling atomen.
Voorbeelden van moleculen
De eenvoudigste moleculen zijn H2, O2 en N2. Waterstof, zuurstof en stikstof bestaan elk uit twee gelijke atomen. Andere eenvoudige moleculen die zijn opgebouwd uit twee verschillende atomen zijn bijvoorbeeld koolmonoxide (CO), waterstoffluoride (HF) en waterstofchloride (HCl). De eenvoudigste moleculen opgebouwd uit drie atomen zijn water (H2O), kooldioxide (CO2) en zwavelwaterstof (H2S). Waterstofcyanide bestaat uit drie verschillende atomen: HCN.H2, O2, N2, CO, CO2, HF en HCl en ook HCN zijn voorbeelden van anorganische stoffen. Op grote schaal geproduceerde anorganische verbindingen zijn zwavelzuur (H2SO4) en ammoniak (NH3).
Zouten vormen een klasse van anorganische verbindingen. Zouten zijn opgebouwd uit ionen: deeltjes met een positieve of negatieve elektrische lading. Een ion kan bestaan uit een enkel atoom of uit meerdere atomen. De eenvoudigste zouten bestaan uit twee verschillende elementen, meestal een metaalion en een halogeenion. Het bekendste voorbeeld is keukenzout, NaCl, dat is opgebouwd uit Na+- en Cl--ionen.
Ionen spelen een belangrijke rol in elektrochemische reacties en -processen. Deze zijn belangrijk voor de ontwikkeling van nieuwe technieken voor energieconversie: fotovoltaïsche cellen (zon-PV), brandstofcellen) en voor de opslag van energie (batterijen voor mobiele telefoons, laptops, elektrische auto's). Op dit terrein vindt wereldwijd veel onderzoek en ontwikkeling plaats.
De atomen van een metaal zoals ijzer, Fe, worden bijeengehouden door de aantrekkingskrachten in het metaalrooster. Omdat elektronen daarin in zekere mate vrij kunnen bewegen, geleiden metalen elektrische stroom.
Naast de hiervoor genoemde anorganische verbindingen bestaan er ook organische verbindingen. Organische verbindingen zijn opgebouwd uit ten minste koolstof (C) en waterstof (H). De eenvoudigste koolwaterstof is methaan (CH4). Fossiele grondstoffen zijn zonder uitzondering mengsels van koolwaterstoffen.
Energievormen
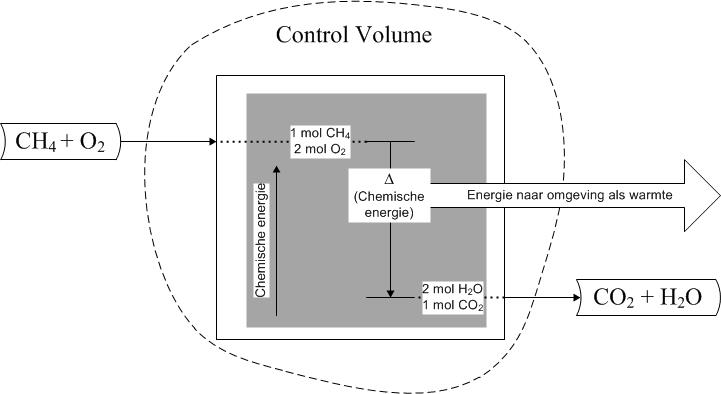
Wat is energie en welke energievormen zijn er? Volgens de wet van behoud van energie kan energie niet verloren gaan en ook niet uit het niets ontstaan, maar kan energie wel van vorm veranderen. In onderstaande figuur is te zien hoe de in methaan (CH4) aanwezige chemische energie wordt omgezet in warmte.
• chemische energie is de energie die een stof heeft als gevolg van de chemische bindingen in deze stof; een stof bestaat immers uit moleculen en deze moleculen bestaan weer uit atomen die door chemische bindingen bij elkaar worden gehouden.
Bij gesloten systemen, dus waarbij er geen massastromen de systeemgrens passeren, kan energie op twee manieren worden uitgewisseld tussen het systeem en de omgeving, of met een ander systeem, namelijk in de vorm van arbeid (W) of in de vorm van warmte (Q):
• arbeid (W) is gedefinieerd als een kracht F die werkt over een bepaalde afstand: δW = F · δl. De eenheid van arbeid is dus: [N] · [m] = [Nm] = [J]
• warmte is gedefinieerd als de vorm van energie die overgedragen wordt tussen twee systemen (of tussen een systeem en zijn omgeving) als gevolg van een temperatuurverschil.
Behalve arbeid en warmte zijn er nog andere vormen van energie, zoals:
• potentiële energie: de energie die een voorwerp heeft als gevolg van zijn positie (hoogte) ten opzichte van de aarde
• kinetische energie: de energie die een voorwerp heeft als gevolg van zijn beweging ten opzichte van de aarde
Een stilstaande kogel op 2 km hoogte heeft een hoeveelheid potentiële energie Epot = m·g·h, waarin m de massa, g de zwaartekrachtsversnelling en h de hoogte is. Als de kogel naar beneden valt verliest deze potentiële energie maar wint deze snelheid, en daarmee kinetische energie: Ekin = 1/2 m·v2, waarin v de snelheid is.
Bij energiesysteemanalyses wordt voor energie de eenheid joule (J) gebruikt. Een (verouderde) eenheid voor energie is de calorie [cal]. De calorie is gedefinieerd als de hoeveelheid warmte nodig om 1 gram water 1 °C in temperatuur te laten stijgen. Deze hoeveelheid warmte, 1 cal, is gelijk aan 4,184 J.
Gerelateerd aan energie is het begrip 'vermogen', de hoeveelheid energie per tijdseenheid, met als eenheid J/s of W (1 J/s = 1 (W)att).
Wet van behoud van energie
Analoog aan de 'wet van behoud van massa zegt de wet van behoud van energie'' dat, behoudens atoomkernreacties, de totale hoeveelheid energie van systeem plus zijn omgeving constant is. Een andere formulering van deze twee wetten is dat zowel massa als energie niet kunnen worden gecreëerd noch vernietigd.
Waar de wet van behoud van massa de basis is voor een boekhouding van materialen, is de wet van behoud van energie dat voor energie: deze boekhouding dient altijd sluitend te zijn.
Enkele voorbeelden:
• behoud van massa: als bekend is dat een afvalverbrandingsinstallatie per ton afval 100 kilogram aan bodemassen produceert, dan verdwijnt de overige 900 kilogram samen met de toegevoerde verbrandingslucht door de schoorsteen van de installatie (verondersteld dat de installatie continu werkt).
• behoud van massa: als de Rotterdamse haven jaarlijks 200 miljoen containers verwerkt en de totale hoeveelheid containers aanwezig in de Rotterdamse haven niet verandert, dan worden er zowel 200 miljoen containers aangevoerd, alsook 200 miljoen containers afgevoerd.
• behoud van energie: als een elektriciteitscentrale continu een kolenstroom verwerkt van 2000 MW en 1000 MW elektriciteit generereert, dan gaat er 1000 MW verloren naar het koelwater en het rookgas dat de centrale verlaat.
• behoud van energie: als een kantoorgebouw bij zonnig zomers weer 1000 kW aan zonnestraling ontvangt via de ramen, dan dient de airconditioning in dat gebouw minstens 1000 kW warmte af te kunnen voeren om te voorkomen dat de temperatuur in het gebouw stijgt.
Net als bij het werken met massabalansen is bij het werken met energiebalansen een systeembenadering op te zetten waarin onderscheid wordt gemaakt tot systeem en omgeving en waarbij vier typen open/gesloten systemen onderscheiden kunnen worden.
De wet van behoud van energie vormt de basis voor het opstellen van een energiebalans over een systeem. Voor elk systeem zal altijd gelden:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = \accumulatie $$
Wanneer er sprake is van het omzetten van de ene energievorm in de andere, energieconversie, moet er goed worden opgelet dat alle in- en uitgaande energiestromen worden meegenomen bij het opstellen van de energiebalans.
Energieconversie
In module TB141E, Introductie in Energie- & Industriesystemen, is aan de hand van de Nederlandse energiebalans al kort ingegaan op het verbruik van energiedragers in de verschillende sectoren.
Enkele voorbeelden van energieconversiesystemen zijn:
• in een fornuis wordt brandstof gecontroleerd verbrand met lucht, zodat de vrijkomende warmte kan worden benut om eten te koken, maar ook om bijvoorbeeld water om te zetten in stoom, of om een reactiemengsel te verwarmen.
• een centrale verwarmingsinstallatie (kortweg CV-installatie of CV) zorgt voor ruimteverwarming. In ons land is ruimteverwarming een deel van het jaar nodig doordat geen enkele (woon)ruimte perfect geïsoleerd is en na verloop van tijd door warmteverliezen dezelfde temperatuur zou aannemen als haar omgeving. 90% van de Nederlandse huishoudens heeft een centrale verwarmingsinstallatie gestookt op aardgas. De chemische energie van het methaan wordt omgezet in warmte die via de radiatoren wordt afgegeven aan de woonruimtes.
• een auto heeft kracht, vermogen, nodig om te versnellen en om in beweging te blijven. Ontbreekt aandrijfvermogen dan komt de auto onvermijdelijk tot stilstand door wrijving (lucht, wielen). De meeste auto's zijn uitgerust met een verbrandingsmotor die de brandstof (benzine, diesel, LPG) gebruikt om een as te laten draaien die de wielen aandrijft. Elektrische auto's gebruiken elektriciteit opgeslagen in een batterij voor de elektromotoren die de aandrijving verzorgen.
• in een batterij vindt een elektrochemische reactie plaats waardoor een potentiaalverschil tussen de twee elektrische polen ontstaat. Als deze, via een (elektrische) weerstand (de gebruiker van elektriciteit) worden verbonden, dan zal een stroom gaan lopen, en wordt het verbonden apparaat (de gebruiker) van elektriciteit voorzien.
• in moderne elektriciteitscentrales worden hoge-druk stoomturbines (steenkool, nucleair) toegepast, in aardgascentrales zijn het gasturbines, en in waterkrachtcentrales zijn hydroturbines in gebruik om kracht (beweging) door middel van een generator om te zetten in elektriciteit.
Typen energieconversie
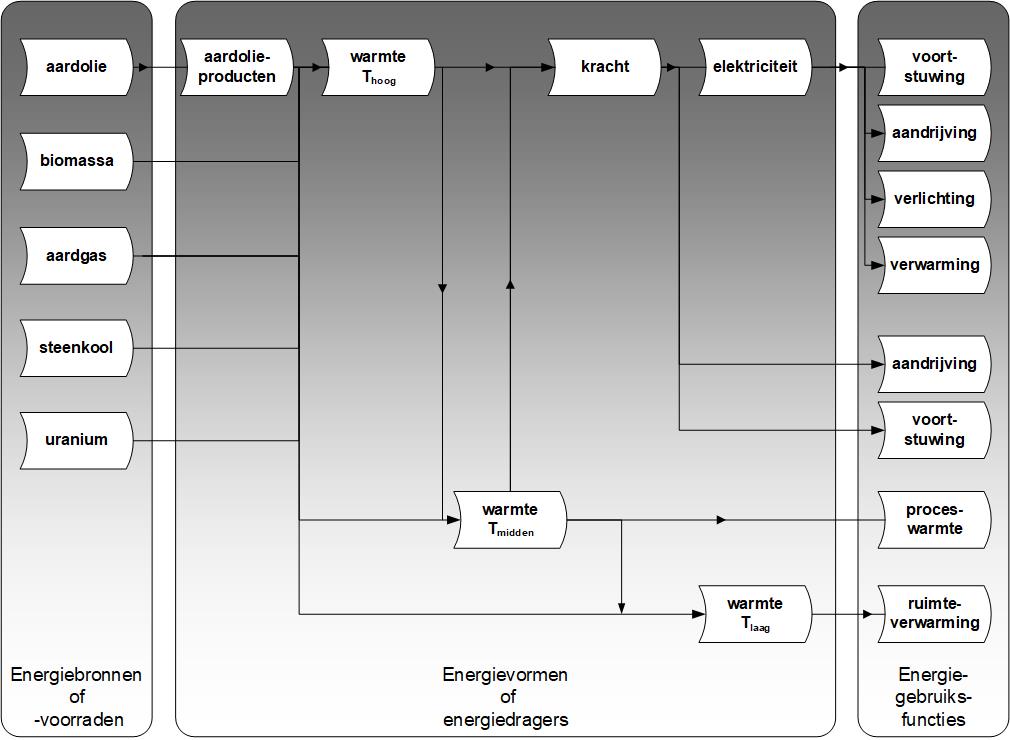
In bovengenoemde systemen treedt per saldo slechts een beperkt aantal typen energieomzettingen op, zie ook onderstaande figuur.
Een aantal van deze energieomzettingen vindt spontaan (in de natuur) plaats, bijvoorbeeld de overdracht van warmte Q van een reservoir met hoge temperatuur naar een reservoir met lage temperatuur. Ook de omzetting van elektriciteit in warmte (bij het geleiden van stroom door een weerstand) gaat vanzelf, net als het omzetten van arbeid in wrijvingsverlies. Door deze omzettingen gecontroleerd te laten plaatsvinden kan daadwerkelijk nuttig gebruik worden gemaakt van het product van de omzetting en daarmee van de kostbare energiedrager.
De omgekeerde omzettingen, warmte van lage naar hoge temperatuur of van warmte naar kracht, gaan nooit spontaan. Daar zijn altijd technische installaties voor nodig, respectievelijk een warmtepomp en een thermische (elektriciteits)centrale.
De volgende typen energieconversie zijn in de figuur te onderscheiden:
• omzetting van chemische of verbrandingsenergie (LHV) in warmte van hoge temperatuur (Th = 800-2000 °C) door verbranding, bijvoorbeeld in fornuis. Voorbeelden zijn:
- verbranding van aardgas in een CV-installatie, gasturbine of industrieel fornuis
- stoken van het fornuis van grote elektriciteitscentrales met poederkool en/of biomassa
- gebruik van hoogoven gas (een mengsel van CO en H2) als brandstof in een warmtekrachtcentrale
- gebruik van benzine, diesel en LPG in verbrandingsmotoren
- stoken van de barbecue met houtskool
• splijting van uranium tijdens een kernreactie voor de productie van warmte
• conversie van een warmtestroom Q naar een warmtestroom met lagere temperatuur, d.m.v. een warmtewisselaar:
- van hoge temperatuur Th (800-2000 °C) naar middentemperatuur Tm (200-800 °C). Een voorbeeld is de overdracht van verbrandingswarmte uit rookgas naar (hoge-druk) stoom in een elektriciteitscentrale.
- van middentemperatuur Tm (200-800 °C) naar lage temperatuur Tl (60-200 °C). Belangrijkste voorbeeld is de overdracht van de warmte van de verbrandingskamer in een CV-ketel naar het water dat verwarmd wordt.
- van lage temperatuur Tl (60-200 °C) naar omgevingstemperatuur T0 (5-25 °C). Dit is meestal de laatste stap in ruimteverwarming. Ook in elektriciteitscentrales vindt deze transformatie plaats bij het afgeven van restwarmte aan koelwater.
• conversie van een warmtestroom Q (Th) naar arbeid W (via stoom- en/of gascyclus). Dit is de belangrijkste energieconversie: het omzetten van warmte naar arbeid (elektriciteit) stelt ons in staat productie en transport te mechaniseren. Tegenwoordig zijn er twee hoofdtypen energieconversiesystemen waarin deze conversie wordt gerealiseerd:
- zonder co-productie van een nuttig te gebruiken warmtestroom. Naast de omzetting van warmte Q (Th) naar arbeid W ontstaat (onvermijdelijk) een warmtestroom op omgevingstemperatuur Qrest(T0). Anders gezegd: een grootschalige elektriciteitscentrale produceert slechts elektriciteit als nuttig product.
- mét co-productie van een warmtestroom die nuttig wordt toegepast, bijvoorbeeld in een fabriek, tuinbouwkas of stadsverwarmingsnet. Naast arbeid produceert een warmtekrachtcentrale dan een warmtestroom Qproduct (Tm en/of Tl).
• arbeid W opgewekt uit Q (Th) kan vervolgens gebruikt kan worden om:
- een generator aan te drijven, dit is een grote dynamo voor het opwekken van elektrische (wissel)stroom
- rechtstreeks aandrijving en voortstuwing te verzorgen (aandrijfas van machines, auto's etc); veelal wordt hierbij een tandwielkast of versnellingsbak toegepast om het aantal omwentelingen te regelen
• elektriciteit kan vervolgens worden gebruikt om een scala aan machines en/of apparaten aan te drijven en voor verlichting en elektrische verwarming.
Een voorbeeld van een energiesysteem waarin de hiervoor beschreven energieomzettingen te vinden zijn is een centrale verwarmingsinstallatie.
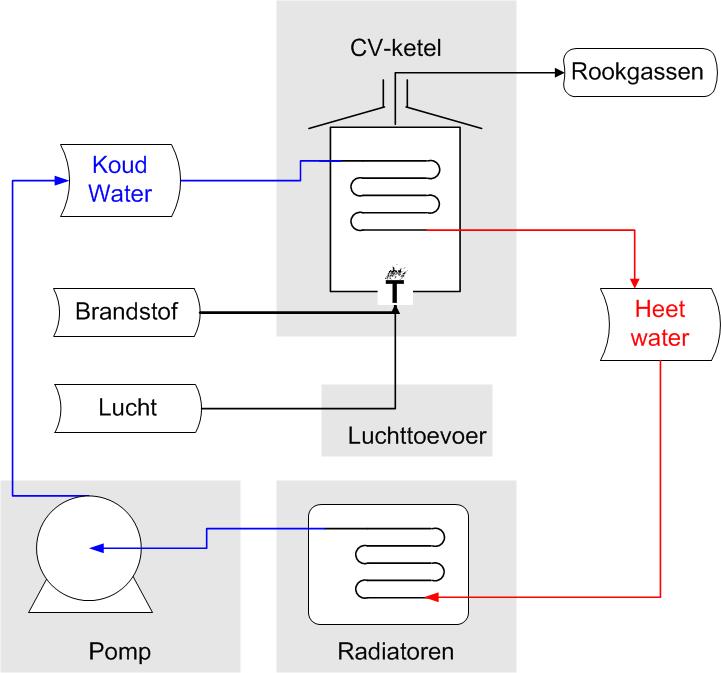
Centrale verwarmingsinstallatie
Een centrale verwarmingsinstallatie (CV-installatie of kortweg CV) kan schematisch weergegeven worden zoals in onderstaande figuur.
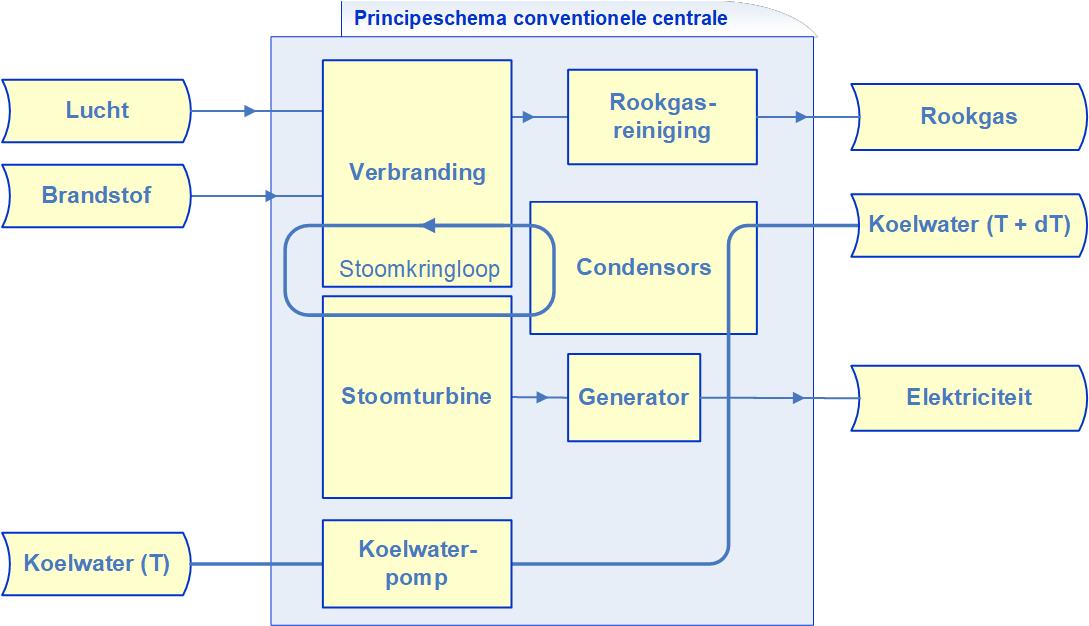
In een CV-installatie wordt brandstof, in Nederland meestal aardgas, met lucht verbrand. De chemische energie in de brandstof komt vrij als warmte (de vuurhaardtemperatuur is ± 1100 °C) waardoor de ontstane rookgassen een hoge temperatuur Th krijgen. De warmte in het rookgas wordt via een warmtewisselaar(*) overgedragen aan koud water dat afkomstig is van de radiatoren. Na passage van de warmtewisselaar voert het nu opgewarmde radiatorwater met temperatuur Tl de overgedragen warmte naar de radiatoren in de huiskamer. Daar vindt tenslotte de omzetting van lage-temperatuur warmte naar huiskamerwarmte plaats: Q (Tl) → Q (T0).
De installatie werkt met een elektrisch aangedreven pomp die het afgekoelde radiatorwater weer terugpompt naar de ketel. Hier wordt dus elektriciteit omgezet in arbeid die gebruikt wordt om de kinetische en potentiële energie van het water te verhogen. Deze gaat verloren door wrijving in het systeem, waarbij wederom warmte ontstaat. De laatste energieomzetting is die van restwarmte van midden- of lage temperatuur in het rookgas naar omgevingstemperatuur.
De energieconversie van lage temperatuur Tl naar omgevingstemperatuur T0 = 10-25 °C verloopt in veel gevallen spontaan - denk bijvoorbeeld aan de afkoeling van een kamer als de verwarming uitgezet wordt - maar vaak ook actief door het gebruik van koeling (met lucht of water). Bijvoorbeeld door te ventileren of te koelen om de warmte af te voeren die afgegeven wordt door elektrische apparatuur die in een afgesloten ruimte staat te draaien.
In Nederland is meer dan 90% van de huishoudens uitgerust met een CV-installatie met eigen ketel. Slechts een beperkt aantal huishoudens gebruikt nog kachels of is aangesloten op een stadsverwarmingsnet. Bij 90% van de huishoudens valt dus de verwarming uit als de elektriciteit uitvalt doordat de werking van zelfs een eenvoudige CV-ketel afhankelijk is van de werking van de circulatiepomp. Moderne, geavanceerde CV-ketels gebruiken daarnaast elektriciteit voor de ingebouwde elektronica voor besturing en beveiliging.
In het Verenigd Koninkrijk worden veel woningen verwarmd met elektriciteit. Tot 1950-1960 gebruikte men steenkool (kachels), maar vanwege smogproblemen hebben veel huishoudens gekozen voor elektrische verwarming: stroom (opgewekt uit steenkool) was lange tijd goedkoop en overal beschikbaar. Stadsgas of aardgas was en is lang niet overal beschikbaar in het Verenigd Koninkrijk.
(*) In het vak TB241E, Fysische transportverschijnselen, wordt ingegaan op de werking van warmtewisselaars.
Omzetting van warmte in elektriciteit
Het is onmogelijk om warmte voor 100% in arbeid (elektriciteit) om te zetten. Dit is een formulering van de 2e hoofdwet van de thermodynamica en hier wordt in het vak TB242E, Processen in de energiesector, uitgebreid bij stilgestaan.
Volgens deze 2e hoofdwet van de thermodynamica:
• stroomt energie in de vorm van warmte spontaan van een hoog temperatuurniveau naar een laag temperatuurniveau, maar NIET andersom. Ook al is de hoeveelheid lauwwarm water nog zo groot, er is geen apparaat denkbaar om daar spontaan een heet bad van te maken. Een gekoeld kratje bier neemt vanzelf weer de temperatuur van de kamer aan. Om het bier weer te koelen, zal het een tijdje in de koelkast moeten staan en die trekt stroom uit het stopcontact.
• kan energie in de vorm van arbeid wél volledig worden omgezet in warmte, maar kan warmte NIET volledig worden omgezet in arbeid. Voor tijdelijke bijverwarming in een studentenkamer is het gemakkelijk om een elektrisch straalkacheltje te installeren. De 1,5 kiloWatt die zo'n kacheltje uit het stopcontact trekt maakt de ruimte snel behaaglijk warm, maar mocht dat al gewenst zijn dan zou de warmte in die kamer maar voor een zeer klein deel weer terug om te zetten zijn in elektriciteit (arbeid).
Het maximale, theoretische, rendement waarmee warmte omgezet kan worden in arbeid wordt gegeven door het Carnot-rendement.
Carnot-rendement
Het Carnot-rendement is gedefinieerd als:$$ \η_{\C} = 1 - {T_{laag}}/{T_{\hoog}} $$
met:
$T_{\hoog}$ = temperatuur van de warmte die gebruikt wordt om arbeid uit te produceren [K]
$T_{\laag}$ = temperatuur van de (rest)warmte die als gevolg van de 2e hoofdwet afgevoerd moet worden [K]
Rendement van grootschalige elektriciteitscentrales
Aangezien het bij thermische centrales bij uitstek gaat om de omzetting van warmte in arbeid (elektriciteit) is het Carnot-rendement op deze installaties van toepassing. Voor het bepalen van het maximale, theoretische, rendement van een thermische centrale wordt in de formule voor het Carnot-rendement bij Thoog de hoogste temperatuur in de thermische centrale ingevuld (de temperatuur in de vuurhaard, dus daar waar de brandstof wordt verbrand) en bij Tlaag de laagste temperatuur (die van het koelmedium, meestal koelwater).Uit de formule voor het Carnot-rendement volgt dat:
• het maximale, theoretisch haalbare, rendement van de omzetting van warmte in arbeid toeneemt als Thoog hoger wordt:
- dit betekent dat de temperatuur in de verbrandingsoven ter plaatse van de stoompijpen van de centrale hoger moet liggen, maar:
- deze temperatuur wordt op haar beurt begrensd door de maximaal met de brandstof te bereiken (adiabatische) vlamtemperatuur en door de inrichting van het fornuis en
- verlaging van de oventemperatuur kan nodig zijn vanwege veiligheidseisen en de eigenschappen van de in de oven cq. de stoompijpen gebruikte materialen. Denk hierbij aan de sterkte bij hoge druk en temperatuur en aan de inwerking van corrosieve verbindingen in het rookgas.
• het maximale, theoretisch haalbare, rendement van de omzetting van warmte in arbeid toeneemt als Tlaag lager wordt:
- dit betekent dat er voor een maximaal rendement van een elektriciteitscentrale gezocht wordt naar een zo laag mogelijke koelwatertemperatuur.
- deze temperatuur bepaalt tegen welke temperatuur de afgewerkte stoom uit de stoomturbine kan worden gecondenseerd.
- deze temperatuur varieert meestal door het jaar heen. In het binnenland kan de oppervlaktewatertemperatuur van rivieren 's zomers flink stijgen. De fluctuatie van de zeewatertemperatuur is meestal kleiner. Is een koeltoren geïnstalleerd dan vertaalt een hogere buitenluchttemperatuur zich direct in een verlaagd rendement van de centrale.
Het praktisch gerealiseerde rendement van een thermische centrale ligt (uiteraard) lager dan het maximale, theoretisch haalbare, Carnot-rendement en wordt bepaald door:
• het werkelijke rendement van alle apparaten in de centrale (stoomketel, warmtewisselaars, leidingen, stoomturbine, pompen, ...) en
• het interne elektriciteitsverbruik van apparatuur in de centrale nodig voor continue bedrijfsvoering (molens voor het vermalen van steenkool, koelwaterpompen, ventilatoren en circulatiepompen in de rookgasreiniging zijn hierbij de grootste verbruikers).
Voor het berekenen van de benodigde hoeveelheid koelwater om de restwarmte weg te koelen is niet alleen de temperatuur maar ook de warmtecapaciteit van het koelwater van belang.
Warmtecapaciteit
Voor het berekenen van de benodigde hoeveelheid koelwater is de warmtecapaciteit van het koelmedium belangrijk. De warmtecapaciteit is de hoeveelheid warmte die opgenomen wordt per graad temperatuurstijging (of eigenlijk: de hoeveelheid warmte die benodigd is per graad temperatuurstijging), zie hiervoor ook de definitie van de calorie.
Elke stof heeft een eigen warmtecapaciteit. De specifieke warmtecapaciteit, dat wil zeggen de warmtecapaciteit per hoeveelheid massa, wordt uitgedrukt in de eenheid kJ/kgK (of J/gK). De warmtecapaciteit van een vloeistof is licht afhankelijk van de temperatuur van die vloeistof. Voor water bij 1 bar en temperaturen tussen 20 en 60 °C bedraagt de specifieke warmtecapaciteit ca. 4,18 kJ/kgK. Voor globale energiesysteemanalyses kan de warmtecapaciteit constant worden verondersteld, maar bij gedetailleerde ontwerpberekeningen moet de temperatuursafhankelijkheid uiteraard meegenomen worden. Een andere benaming voor de specifieke warmtecapaciteit is de soortelijke warmte.
Uit de definitie en eenheid van de specifieke warmtecapaciteit volgt als vanzelf (controle eenheden!) dat geldt:
$$ Q = φ_{\m} · c_p · \ΔT $$
met:
$Q$ = hoeveelheid warmte [kJ/s]
$φ_{\m}$ = massastroom [kg/s]
$c_\p$ = specifieke warmtecapaciteit bij opwarming bij constante druk [kJ/kgK]
$\ΔT$ = temperatuurverschil [K] (of °C want het gaat hier om het verschil en er geldt 273,15 K = 0 °C)
Toepassingsvoorbeelden
Met behulp van deze eenvoudige vergelijking kan berekend worden tot welke temperaturen warmtestromen of warmtelozingen leiden. Zo zou bijvoorbeeld geschat kunnen worden hoeveel de temperatuur van het IJsselmeer toeneemt ten gevolge van de stroomproductie in de Máximacentralew. Deze heeft een elektrisch vermogen van zo'n 1000 MW. Doordat het rendement ongeveer 60% bedraagt, gaat 40/60 · 1000 = 667 MW aan warmte met het opgewarmde koelwater het IJsselmeer in. Als bekend is hoeveel water door het IJsselmeer stroomt (van de IJssel via de sluizen in de Afsluitdijk naar de Waddenzee) kan een schatting worden gemaakt van de maximale temperatuurstijging door aan te nemen dat er sprake is van ideale menging en dat er geen warmte naar de lucht verdwijnt maar dat alle restwarmte van de Máximacentrale terecht komt in het IJsselmeer.
Wat dichter bij huis kan deze formule gebruikt worden om uit te rekenen hoeveel elektriciteit er nodig is om een bad van 200 liter water te vullen met water van 40 °C uit een elektrische boiler.
Uit de formule blijkt ook dat bij het opslaan van warmte de grootte van zo'n opslagsysteem beperkt kan worden door een stof met hoge warmtecapaciteit te kiezen dan wel een groot temperatuurverschil te gebruiken. Vanwege de veiligheid wordt voor warmteopslagsystemen echter meestal water gebruikt. In Nederland wordt bijvoorbeeld steeds meer warmte/koude opslag gebruikt: 's zomers wordt warmte opgevangen in een tuinbouwkas of gebouw gebruikt om opgepompt diep grondwater op te warmen, dat vervolgens weer teruggevoerd wordt, bijvoorbeeld zo'n 300 m onder de grond. In de winter vindt het omgekeerde proces plaats. Glastuinders hebben vaak een bovengrondse warmteopslag geïntegreerd met hun warmtekrachtcentrale waarin ze warm water van zo'n 80-90 °C opslaan. Deze voorraad is meestal voldoende om de kas twee à drie dagen van warmte te voorzien.
Voor energiesysteemanalyses aan continue systemen kan meestal een voldoende nauwkeurige berekening uitgevoerd worden door aan te nemen dat het warmteverlies naar de omgeving van de installatie te verwaarlozen is.
Koeling van thermische centrales
Het aandeel restwarmte dat ontstaat bij de verbranding van steenkool is GROTER dan het aandeel elektriciteit: een typische steenkoolcentrale die 1000 MW elektrisch vermogen levert, genereert ook zo'n 1100 MW aan restwarmte, continu! Deze hoeveelheid is evenveel als de warmtebehoefte van 100.000 huishoudens op een winterse dag.
De keuze voor de methode van koeling is dan ook erg belangrijk: om te verzekeren dat de centrale altijd kan en mag blijven werken, en voor de beheersing van de kosten. De restwarmtestroom vormt een zeer belangrijke fysieke relatie met de directe omgeving van de centrale. Er zijn ruwweg twee mogelijkheden om de restwarmte te lozen in de omgeving: naar een oppervlaktewatersysteem of naar de lucht. Daarnaast is het ook mogelijk om restwarmte nuttig te gebruiken.
Directe koeling met een oppervlaktewatersysteem
Voor het wegkoelen van de restwarmte kan een warmtewisselaar worden gebruikt waar aan de warme kant de afgewerkte stoom uit de stoomturbine wordt geleid en aan de koude kant koelwater of koellucht. Omdat een grote centrale van 1000 MW wel 1100 MW restwarmte produceert, is directe koeling met lucht meestal geen optie - er zou een zéér grote installatie moeten worden gebouwd, tegen zeer hoge kosten. Water kan per m3 veel meer warmte opnemen dan lucht. Grote centrales worden dan ook vaak aan zee of aan grote rivieren gebouwd. Aan deze watersystemen kunnen zij dan stroomopwaarts het benodigde koelwater onttrekken en stroomafwaarts van de centrale kan het opgewarmde koelwater geloosd worden op de rivier. Wordt zeewater gebruikt op een kustlocatie, dan dienen in- en uitlaatpunten zo te worden gekozen dat geen circulatie van geloosd koelwater naar de inlaat optreedt, want dat zou nadelige effecten voor het rendement van de centrale hebben.Bij kerncentrales is niet alleen koeling van de afgewerkte stoom nodig, maar ook van de reactorkern; als deze koeling wegvalt én de zogenaamde moderatoren falen dan is er in oudere typen kerncentrales gevaar van oververhitting van de kern. Dat is één van de redenen waarom kerncentrales vaak aan zee worden gebouwd: daar is in principe altijd voldoende koelwater.
Indirecte koeling met een koeltoren
Het is ook mogelijk grote centrales te bouwen op locaties waar geen grote hoeveelheden oppervlaktewater beschikbaar zijn. De centrale wordt dan uitgebreid met één of meer koeltorens waarin water verdampt wordt. Het gaat hier dan om indirecte koeling: in plaats van inname van koelwater en lozing naar rivier of zee wordt koelwater nu continu gerecirculeerd via de koeltoren. In de koeltoren wordt het opgewarmde koelwater in temperatuur verlaagd door water te sproeien en dat met de restwarmte uit de centrale te laten verdampen. Het verdampen van het water kost warmte en aangezien deze warmte afkomstig is van het koelwater neemt de temperatuur van het koelwater daardoor af. Er kan met een relatief kleine hoeveelheid te verdampen water worden volstaan doordat de benodigde hoeveelheid warmte om water te verdampen vele malen groter is dan de warmtecapaciteit van water.Omdat koeltorens werken met natuurlijke convectie, net als bij een schoorsteen stroomt de lucht door natuurlijke trek van onder naar boven, en vanwege de grote hoeveelheden weg te koelen warmte zijn koeltorens enorme installaties van typisch zo'n 70 m diameter en 130 m hoogte.
Nadelen van een hogere koelwatertemperatuur
Als een thermische centrale in bedrijf is, zal naar gelang het jaargetijde de werkelijke koelwaterinlaattemperatuur afwijken van de ontwerptemperatuur; met name in hete zomers zal de temperatuur hoger zijn. Er treden dan twee effecten op die het rendement van de thermische centrale negatief beïnvloeden:• het maximaal te behalen rendement neemt af
• de benodigde hoeveelheid koelwater is groter waardoor er meer energie nodig is om de koelwaterpompen te laten draaien. Bij gelijkblijvende hoeveelheid restwarmte en een kleiner temperatuurverschil tussen het ingenomen en geloosde koelwater zal er immers een grotere hoeveelheid koelwater nodig zijn. Zelfs als ook de temperatuur van het geloosde koelwater toe kan (mag!) nemen, wordt het temperatuurverschil tussen de af te koelen stroom en het koelwater kleiner waardoor de warmteoverdracht slechter verloopt en er ook meer koelwater nodig is.
Toestandsgrootheden
Toestandsgrootheden zijn macroscopische kenmerken van stoffen of systemen die niet afhangen van de weg die gevolgd is om tot de toestand van deze stof of dit systeem te komen, m.a.w.: toestandsgrootheden zijn padonafhankelijk. Voorbeelden van toestandsgrootheden zijn druk, temperatuur en specifiek volume. Het specifieke volume is het volume van een stof per hoeveelheid van die stof.
Een toestandsgrootheid die van belang is bij de analyse van thermische centrales is enthalpie (H). Voor nu is het voldoende om te weten dat met enthalpie de hoeveelheid energie van een stof wordt aangeduid. In het vak TB242E, Processen in de energiesector, wordt dieper ingegaan op de grootheid enthalpie en andere toestandsgrootheden.
De enthalpiewaarde van een fossiele brandstof is hoger dan die van de verbrandingsproducten kooldioxide en water. Dit betekent dat de verbranding van fossiele brandstoffen zorgt voor een afname van de hoeveelheid enthalpie. Deze enthalpieafname is gelijk aan de hoeveelheid warmte die vrijkomt bij de verbrandingsreactie. De enthalpieverandering die optreedt door een reactie wordt de reactie-enthalpie genoemd.
Er kan gekozen worden wat er met de vrijgekomen warmte gedaan wordt: er kunnen immers verschillende technologieën toegepast worden. Bijvoorbeeld, bij de verbranding van een ton steenkool in de open lucht verspreiden de hete rookgassen zich, wordt de vrijgekomen warmte geheel opgenomen door de omgeving en wordt er dus geen arbeid geproduceerd. Echter, wordt de steenkool verbrand in een elektriciteitscentrale, dan wordt ongeveer 45% van de vrijgekomen warmte omgezet in arbeid (de elektriciteit die wordt geproduceerd) en wordt de overige 55% via koelwater, rookgassen en stralingsverlies als warmte afgegeven aan de omgeving. In beide gevallen geldt de wet van behoud van energie.
De enthalpiewaarde van een stof, bijvoorbeeld aardgas, is een toestandsgrootheid en is dus niet afhankelijk van de manier waarop dit aardgas is gevormd, maar alleen van de samenstelling en condities (druk, temperatuur, ...) van dit aardgas.
Warmte en arbeid zijn ook energievormen, maar zijn géén toestandsgrootheden. De hoeveelheden warmte en arbeid zijn wél afhankelijk van de weg/route die afgelegd wordt en de technologie die toegepast wordt. Zie ook het voorbeeld hierboven over de verbranding van steenkool.
Reactie-enthalpie
Bij een reactie zijn de enthalpiewaarde van de grondstoffen, de reactanten, anders dan die van de producten. De totale hoeveelheid enthalpie in de reactanten kan hoger of lager zijn dan de totale hoeveelheid enthalpie in de producten. Het verschil tussen de hoeveelheid enthalpie in de reactanten voordat de reactie plaatsvindt en de hoeveelheid enthalpie in de producten (en misschien ook nog wat reactanten) na afloop van de reactie wordt de reactie-enthalpie genoemd. In formulevorm:
ΔrH = ΣHproducten - ΣHreactanten
Let op: een "Δ" betekent altijd "uit" min "in" oftewel: "producten" min "reactanten".
Als de ΔrH negatief is, is er sprake van een afname in enthalpie. Deze hoeveelheid enthalpie komt vrij als warmte en de reactie wordt dan exotherm genoemd. Wanneer er door het systeem geen arbeid wordt verbruikt of geproduceerd maar alleen warmte wordt uitgewisseld met de omgeving, geldt er:
$$ \Δ_{\r}H = Q $$
NB: Volgens bovenstaande vergelijking is Q een negatief getal bij een exotherme reactie. Bij het vak TB242E, Processen in de energiesector, wordt hier verder op ingegaan. Bij dit vak nemen we voor de vrijkomende warmte de absolute waarde van de reactie-enthalpie, ofwel:
$$ Q = |\Δ_{\r}H| $$
Verbrandingsreacties zijn exotherme reacties. Voor de verbranding van waterstof en methaan met zuivere zuurstof geldt bijvoorbeeld:
H2 + 1/2 O2 → H2O ΔrH = -119,9 MJ/kg H2
CH4 + 2 O2 → CO2 + 2 H2O ΔrH = -50 MJ/kg CH4
De reactie-enthalpie van een verbranding wordt ook wel verbrandingsenthalpie of verbrandingswarmte genoemd. De hoeveelheid energie die vrijkomt bij de verbranding van een brandstof kan worden uitgedrukt in LHV en HHV.
Wanneer een reactie-enthalpie onbekend is, kan deze door toepassing van de wet van Hess berekend worden uit de vormingsenthalpieën van de reactanten en producten.
LHV en HHV van brandstoffen
Een belangrijke eigenschap van brandstoffen is de hoeveelheid energie die vrijkomt bij de verbranding, de reactie-enthalpie van de verbranding.
Bij deze verbrandingsenergie wordt onderscheid gemaakt in de fase (gas of vloeistof) van de verbrandingsproducten en dan met name of het ontstane water aanwezig is in de gasfase (waterdamp) of in de vloeistoffase.
De LHV (Lower Heating Value), ook wel onderste verbrandingswaarde of stookwaarde genoemd, is de verbrandingsenergie wanneer het ontstane water zich in de gasfase bevindt.
De HHV (Higher Heating Value), ook wel bovenste verbrandingswaarde genoemd, is de verbrandingsenergie wanneer het ontstane water zich in de vloeistoffase bevindt. De HHV is hoger dan de LHV doordat bij de berekening van de HHV ook de warmte wordt meegenomen die vrijkomt wanneer water overgaat van de gas- naar de vloeistoffase (de condensatiewarmte).
De deelreacties voor het bepalen van de HHV van methaan zijn:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) (LHV van methaan)
2 H2O(g) → 2 H2O(l) (condensatiewarmte)
en de overall-reactie is:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) (HHV van methaan)
Wet van Hess
Aangezien enthalpie een toestandsgrootheid is, is de enthalpieverandering ΔH tussen toestand 1 en toestand 2 onafhankelijk van de weg die wordt bewandeld om van toestand 1 in toestand 2 te komen. Dit betekent ook dat een reactie kan worden opgeknipt in deelreacties en dat de som van de ΔrH's van de deelreacties gelijk is aan de ΔrH van de gehele reactie. Dit wordt de wet van Hess genoemd.
Bijvoorbeeld voor de enthalpieverandering van de verbranding van methaan geldt dat deze gelijk is aan 50 MJ/kg. Dit geldt zowel wanneer de weg wordt gevolgd van de reactie:
(1) CH4 + 2 O2 → CO2 + 2 H2O
als voor de weg via deelreacties waarbij methaan eerst wordt omgezet in koolmonoxide (CO) en waterstof H2 en waarna de koolmonoxide en waterstof alsnog verbranden tot CO2 en H2O:
(2) CH4 + 1/2 O2 → CO + 2 H2
(3a) CO + 1/2 O2 → CO2
(3b) 2 H2 + O2 → 2 H2O
Volgens de wet van Hess geldt:
ΔrH(1) = ΔrH(2) + ΔrH(3a) + ΔrH(3b)
De wet van Hess is bijzonder handig voor het rekenenen met reactie-enthalpieën. Volgens deze wet kan elke reactie immers worden opgesplitst in deelreacties en kunnen deelreacties worden gecombineerd tot totaalreacties. Op deze manier kunnen dus ontbrekende gegevens van reacties berekend worden. Hierbij zijn twee dingen van belang:
• als de richting van een reactie wordt omgekeerd, verandert het teken van de enthalpieverandering.
• de grootte van ΔrH is afhankelijk van de hoeveelheid reactanten en producten. In tabellenboeken wordt daarom altijd de reactie-enthalpie per mol gegeven en wordt aangegeven op welke reactant de reactie-enthalpie betrekking heeft (bijvoorbeeld per mol methaan).
Toepassingsvoorbeeld
Gevraagd wordt de enthalpieverandering veroorzaakt door onderstaande reactie:(1) 2 CH4 → C2H6 + H2
Bekend is dat de ΔrH van de verbranding van methaan tot CO2 en vloeibaar water (de HHV) ongeveer -891 kJ/mol methaan bedraagt (ca. 55 MJ warmte per kilogram methaan). Als nu ook de ΔrH van de verbranding van waterstof en ethaan (C2H6) bekend zijn, is de gevraagde ΔrH als volgt te berekenen op basis van onderstaande deelreacties:
(2) CH4 + 2 O2 → CO2 + 2 H2O
(3) H2O → H2 + 1/2 O2
(4) 2 CO2 + 3 H2O → C2H6 + 3 1/2 O2
Uit toepassen van de wet van Hess volgt:
ΔrH(1) = 2 · ΔrH(2) + ΔrH(3) + ΔrH(4)
Let hierbij op dat:
• ΔrH(2) = ΔrH(verbranding methaan)
• ΔrH(3) = - ΔrH(verbranding waterstof) (tekenwisseling, want reactie verloopt in omgekeerde richting van de verbrandingsreactie)
• ΔrH(2) = - ΔrH(verbranding ethaan) (tekenwisseling, want reactie verloopt in omgekeerde richting van de verbrandingsreactie)
Vormingsenthalpie
De vormingsenthalpie van een stof is de enthalpieverandering die veroorzaakt wordt door de reactie waarbij de betreffende stof het product is en de reactanten bestaan uit de elementen (koolstof, waterstof, zuurstof, ...) in de juiste hoeveelheid molen om precies 1 mol van de betreffende stof te vormen.
De vormingsreactie van methanol (CH3OH) is bijvoorbeeld:
C + 2 H2 + 1/2 O2 → CH3OH
In tabellenboeken zijn de vormingsenthalpieën (in [kJ/mol]) te vinden voor de vorming van stoffen bij standaardcondities. Dit worden de standaard vormingsenthalpieën genoemd en deze zijn te herkennen aan de 0 bij het symbool, bijv. zoals in ΔfH0. Aangezien het bij vormingsenthalpieën gaat om de enthalpieverandering als gevolg van de vorming van de stof uit de elementen, zijn de vormingsenthalpieën van de elementen zelf per definitie gelijk aan nul!
Afhankelijk van het element is het element bij 25 °C, een veelgebruikte standaardtemperatuur, een gas (bijv. zuurstof), een vloeistof (bijv. kwik) of een vaste stof (bijv. zwavel).
De vormingsenthalpieën kunnen gebruikt worden om de reactie-enthalpie te berekenen. Dit is een toepassing van de wet van Hess.
Berekening vormingsenthalpie uit bindingsenthalpieën
Op dezelfde manier als de reactie-enthalpie berekend kan worden uit de vormingsenthalpieën van de reactanten en producten kan de vormingsenthalpie van een verbinding berekend worden uit de bindingsenthalpieën van de bindingen die verbroken en gevormd worden tijdens de reactie waarbij de betreffende verbinding gevormd wordt uit de elementen waaruit deze verbinding bestaat. De vormingsenthalpie van methaan kan dus berekend aan de hand van de reactievergelijking:C(s) + 2 H2(g) → CH4(g)
en is gelijk aan: 4 · ΔHC-H vormen minus 2 · ΔHH-H verbreken, maar omdat koolstof een vaste stof is moet hier nog de sublimatie-energie van C(s) naar C(g) bij opgeteld worden.
De bindingsenthalpieën van bindingen zijn te vinden in tabellenboeken. Bij het maken van een binding komt warmte vrij, bindingsenthalpieën hebben dus een negatieve waarde. Voor het verbreken van bindingen moet de tegengestelde waarde van de bindingsenthalpie genomen worden; het verbreken van een binding kost energie, de enthalpieverandering is een positieve waarde.
Het aantal atoombindingen dat een atoom kan (en wil) aangaan, de covalantie van een atoom, verschilt per element. De covalentie van koolstof is vier en bij waterstof is de covalentie een. Mogelijke verbindingen bestaande uit alleen koolstof en waterstof zijn dan dus CH4, C2H6, C3H8 of in het algemeen CnH2n+2. Deze verbindingen worden alkanen genoemd. Tussen twee atomen kan ook een dubbele binding zitten, zoals bij C2H4 (etheen) waarbij de beide koolstofatomen met elkaar verbonden zijn door middel van een dubbele atoombinding. Ook driedubbele bindingen zijn mogelijk, bijvoorbeeld bij C2H2 (ethyn). De covalentie van stikstof is drie en van zuurstof twee, vandaar dat het NH3 en H2O is. Bij kooldioxide is het koolstofatoom door middel van twee dubbele bindingen met de zuurstofatomen verbonden. Voor de volledigheid: koolmonoxide heeft een driedubbele binding tussen beide atomen en wijkt hiermee af van de covalentievoorkeur.
Energiesysteemanalyse
Bij een energiesysteemanalyse wordt de informatie van de voorgaande pagina's van dit webdictaat toegepast. Denk hierbij aan het tekenen van een systeemdiagram inclusief in- en uitgaande stromen, het gebruik van massabalansen, het toepassen van de wet van behoud van energie, het berekenen van de reactiewarmte die vrijkomt, het wegkoelen van restwarmte etc etc.
Energiesysteemanalyses kunnen bijvoorbeeld worden gemaakt van een datahotel, van thermische centrales, maar ook van industriële systemen zoals een ammoniakfabriek. Een belangrijk aspect bij energiesysteemanalyses dat nog niet behandeld is, is het energierendement van thermische centrales. Traditionele steenkoolcentrales hebben bijvoorbeeld een lager energierendement dan moderne gascentrales.
Energiesysteemanalyse: voorbeeld datahotel
Datahotels verbruiken veel elektriciteit. Google heeft bijvoorbeeld in het Eemshavengebied in Noord-Groningen een datahotel in gebruik met daarin 100.000 servers. Elke server heeft een elektrisch vermogen van zo'n 0,3 tot 0,5 kW. Of de servers nu rekenen of wachten, de elektronica in de servers zet de toegevoerde elektriciteit om in warmte. Een eenvoudige energiebalans laat zien dat uit het gebouw dus continu warmte moet worden afgevoerd wil de temperatuur constant blijven:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = 0 $$
Een inventarisatie van alle stromen:
• Ein,1 = elektriciteit die naar de servers gaat
• Euit,1 = warmte die afgevoerd moet worden bij de servers
• Ein,1 = 100.000 ·0,5 kW (in dit geval wordt uitgegaan van het maximale vermogen) = 50 MW
Uit de energiebalans volgt dan:
• Euit,1 = 50 MW
Uitgaande van het maximale vermogen van de servers moet er dus continu 50 MW aan warmte worden afgevoerd.
Energiesysteemanalyse: voorbeeld ammoniakfabriek
Ammoniak, NH3, wordt wereldwijd op grote schaal geproduceerd als grondstof voor kunstmest. De uitvinding van het Haber-Bosch-proces (1908) voor de synthese van ammoniak uit stikstof was een doorbraak die relatief goedkope productie van stikstofkunstmest mogelijk maakte en in de decennia daarna heeft geleid tot sterke productiviteitsverhoging van de landbouw.
Ammoniak heeft een stookwaarde (LHV) van 19,9 MJ/kg. In een ammoniakfabriek wordt ammoniak gemaakt uit methaan CH4 en lucht. De volgende overall-reactie treedt op:
2 CH4 + N2 + 2 1/2 O2 → 2 NH3 + 2 CO2 + H2O
In het daadwerkelijke proces wordt eerst synthesegas gemaakt uit methaan met lucht, daaruit wordt CO2 verwijderd zodat een mengsel van N2 en H2 ontstaat dat kan reageren tot NH3. Deze laatste stap is het Haber-Bosch-procédé.
Vraag:
Als de stookwaarde (LHV) van methaan 50 MJ/kg bedraagt en aangenomen wordt dat er verder geen verliezen optreden, hoeveel warmte wordt er dan in de fabriek geproduceerd?
Het antwoord kan bepaald worden met een energiebalans. Wanneer aangenomen wordt dat de fabriek continu produceert geldt er:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = 0 $$
Een inventarisatie van alle stromen (zie onderstaande figuur):
• inputs: methaan, lucht
• outputs: ammoniak, CO
Lucht, CO
$$ Q = φ_{\m,\methaan} · LHV_{\methaan} - φ_{\m,\ammoniak} · LHV_{\ammoniak} $$
Uit de reactievergelijking volgt dat er 1 mol NH3 per mol CH4 ontstaat. De molgewichten van methaan en ammoniak zijn respectievelijk ongeveer 16 en 17 g/mol, dus per kg geproduceerd ammoniak is er 16/17 kg methaan nodig en er geldt:
$$ φ_{\m,\methaan} = 16/17 · φ_{\m,ammoniak} $$
De geproduceerde hoeveelheid warmte per kg ammoniak is dan:
$$ {Q}/{φ_{\m,\ammoniak}} = 16/17 · LHV_{\methaan} - LHV_{\ammoniak} = {16}/{17} · 50 - 19,9 = 27,2 {\MJ}/{\kg \ammoniak} $$
In de fabriek ontstaat per kilogram ammoniak dus 27,2 MJ warmte(!). Of deze warmte nuttig kan worden benut hangt af van de inrichting van het industriële proces, de stand der techniek én of er potentiële gebruikers van deze warmte zijn op niet al te grote afstand van deze fabriek (wat meestal binnen een straal van 10 tot 25 km betekent).
Energierendement
Volgens de wet van behoud van energie moet voor elk systeem de energiebalans sluitend zijn. Voor een stationair systeem waarin geen accumulatie optreedt geldt:
$$ \ΣE_{in,i} = \ΣE_{\uit,j} $$
Het energierendement van het systeem is daarmee dus 100%! Hoe kan het dan dat er toch van energierendementen lager dan 100% gesproken wordt?
Dat kan alléén als de in- en uitgaande stromen een label gegeven wordt, bijvoorbeeld gewenst (energie)product, afvalwarmte, etc. Een grootschalige elektriciteitscentrale heeft bijvoorbeeld elektriciteit als gewenst, nuttig energieproduct. Het nuttig energierendement is dan:
$$ η = {\elektriciteitsproductie} / {φ_{\m,\brandstof} · LHV_{\brandstof} $$
Het is gebruikelijk om het over het energierendement te hebben, terwijl eigenlijk het nuttig energierendement bedoeld wordt. Verder worden bij energierendementsberekeningen de subschriften 'e' en 'th' gebruikt om aan te geven dat het om elektriciteit, respectievelijk warmte gaat. Zo wordt met ηe het elektrisch rendement en met ηth het thermisch rendement bedoeld. Ook gaat het bij de eenheden MWe en MWth om het elektrisch resp. thermisch vermogen. De eenheid MWth wordt niet alleen voor het thermisch (ingangs)vermogen gebruikt, maar ook voor het nominaal thermisch (uitgangs)vermogen: de hoeveelheid warmte die de installatie levert per tijdseenheid. Het is hier dus goed opletten welke van de twee bedoeld wordt.
Bij een centrale verwarmingsinstallatie is het nuttig energieproduct de hoeveelheid warmte afgegeven door de radiatoren. De energietoevoer van een CV-systeem bestaat uit de brandstof (in Nederland meestal aardgas van Groningen-kwaliteit). Het (nuttig) energierendement is dus:
$$ η = {Q_{\radiatoren}} / {φ_{\m,\aardgas} · LHV_{\aardgas}} $$
In veel gevallen kunnen de gegevens nodig om deze rendementen daadwerkelijk te berekenen afgeleid worden uit de gegevens die bekend zijn over het systeem. Daarbij kunnen massa- en energiebalansen gebruikt worden om ontbrekende gegevens te berekenen, zoals bij de berekening van het energierendement van een warmtekrachtcentrale.
Energierendement warmtekrachtcentrale
De warmtekrachtcentrale van E.ON in Rotterdam-Alexander levert warmte aan het stadsverwarmingsnet (huizen, winkels, kantoren). De installatie levert bij normaal bedrijf 250 MW aan het elektriciteitsnet en er verdwijnt 75 MW restwarmte met het rookgas. De centrale gebruikt 800 MW aan hoogcalorisch aardgas als brandstof.
Wat is het nuttig energierendement van de centrale?
Beantwoording
Gebruik hiervoor de systeembenadering:
1a. Lees de systeembeschrijving. Het gaat om een warmtekrachtcentrale dus in aanvulling op de stromen van beschrijving produceert de WKC ook nog nuttige warmte.
1b. Leg de systeemgrens om de WKC. Inventariseer alle stromen en teken het systeemdiagram (onderstaande tabel en figuur).
| Inputs | Outputs | ||
| Naam | Hoeveelheid [MW] | Naam | Hoeveelheid [MW] |
| aardgas | 800 | elektriciteit | 250 |
| lucht | 0 | nuttige warmte | ? |
| rookgas | 75 |
2. Eerste schatting van het antwoord is 80-90%.
3. Oplossingstrategie:
• Gevraagde rendement: η = (Eelektriciteit + Qnuttig) / (Eaardgas)
• Opstellen energiebalans: Eaardgas + Elucht = Eelektriciteit + Qnuttig + Q
4. Oplossing:
• Qnuttig = 800 MW + 0 MW - 250 MW - 75 MW = 475 MW
• η = (250 MW + 475 MW) / 800 MW = 91%
5. Controle: Het berekende antwoord klopt met de eerste schatting.
Merk hierbij op dat bij de bepaling van dit overall rendement de producten elektriciteit en warmte als gelijkwaardig worden beschouwd. In het vak TB242E, Processen in de energiesector, wordt behandeld dat elektriciteit en warmte volgens de 1e en 2e hoofdwetten van de thermodynamica verre van gelijkwaardig zijn.
Rendement van de warmtekrachtcentrale in de zomer
In de zomer is er veel minder vraag naar warmte van de huishoudens aangesloten op het stadsverwarmingsnet doordat ruimteverwaring in deze periode meestal niet nodig is en de huishoudens slechts warm tapwater gebruiken. Als er (zoals in dit geval) geen andere mogelijkheid is om de warmte als product af te zetten, wordt in deze periode een speciale restwarmtekoeler bijgeschakeld waarmee bij gelijkblijvende elektriciteitsproductie 90% van de geproduceerde warmte wordt weggekoeld. Hoe groot is in dit geval het energierendement van de WKC?Bij het doorlopen van dezelfde stappen als hierboven, komt naar voren dat er nu een extra energiestroom is, nl. Ekoelwater met een hoeveelheid van 0,9 · Qnuttig. Qnuttig,zomer is daarmee gelijk aan 0,9 · Qnuttig.
Het gevraagde energierendement wordt daarmee: ηzomer = (250 MW + 0,1 · 475 MW) / 800 MW = 37%
Bovenstaande is een voorbeeld van hoe met beschikbare gegevens relatief eenvoudig een eerste indruk gekregen kan worden van de stromen en het energierendement van een energieconversiesysteem door een 'black box'-benadering toe te passen.
Beschrijving van een elektriciteitscentrale met alleen een stoomcyclus
De eerste (kolengestookte) elektriciteitscentrales hadden alleen een stoomcyclus. Deze conventionele centrales produceren stoom door verbranding van een brandstof, waarna de stoom door een stoomturbine wordt geleid en er vervolgens door de daaraan gekoppelde generator elektriciteit geproduceerd wordt. Tegenwoordig worden vaak ook gasturbines toegepast, maar bijv. biomassacentrales en kerncentrales passen nog steeds alleen een stoomcyclus toe voor de omzetting van warmte in arbeid (elektriciteit). In onderstaande figuur is het principeschema van zo'n conventionele elektriciteitscentrale weergegeven. Het elektrisch rendement bedraagt zo'n 35 tot 40%.
Beschrijving conventionele elektriciteitscentrale:
• brandstof wordt met lucht verbrand. De chemische energie van de brandstof wordt omgezet in warmte Q (= ΔrH van de verbranding van de brandstof).
• een klein deel van deze warmte verlaat de centrale met het rookgas (Qrookgas).
• de overige warmte Qstoomcyclus = Q - Qrookgas wordt in een zogenaamde stoomcyclus omgezet in elektriciteit (arbeid, W) en restwarmte Q:
- een groot deel van de vrijgekomen verbrandingswarmte, Qstoomcyclus, wordt overgedragen aan water van hoge druk (typisch 120 bar), dat bij hoge druk en temperatuur verdampt tot hoge-druk stoom
- deze hoge-druk stoom drijft een (condenserende) stoomturbine aan, die een generator aandrijft waarmee elektriciteit, W, wordt opgewekt. In de turbine nemen de stoomdruk en temperatuur af.
- in de condensor wordt de afgewerkte stoom uit de turbine gecondenseerd bij lage druk. Dat is nodig om met weinig vermogen het water (als vloeistof) weer op hoge druk te kunnen brengen.
- dit water wordt met een pomp (niet weergegeven in het schema) weer op hoge druk gebracht en naar de warmtewisselaars in de verbrandingsoven gepompt.
• in de condensors van de elektriciteitscentrale wordt de afgewerkte stoom met koelwater (zeewater, rivierwater) gecondenseerd tot vloeibaar water. Het koelwater neemt daarbij een hoeveelheid warmte Qrestwarmte op. Deze Qrestwarmte = Qstoomcyclus - W (bij benadering, er zullen ook warmteverliezen naar de lucht zijn).
• een deel van de opgewekte elektriciteit W wordt in de centrale zelf gebruikt. Bijvoorbeeld voor het vermalen van de brandstof en voor de rookgasreiniging.
• voor de netto elektriciteitsproductie Wnetto geldt: Wnetto = W - Wintern verbruik
In het ideale (dus theoretische) geval is het energierendement van de stoomcyclus (η = Qstoomcyclus/W) gelijk aan het Carnot-rendement.
In aanvulling op de figuur is uit bovenstaande beschrijving duidelijk dat in deze stoomcyclus verschillende energieomzettingen optreden, zoals:
• verdamping: toevoer van warmte Q bij hoge temperatuur Th aan een vloeistof (water) onder hoge druk p > 100 bar. De warmte Q wordt overgedragen aan het water dat bij een iets lagere temperatuur Th - δT verdampt. Er geldt Q = ΔHverdamping.
• expansie: tijdens de expansie van hoge-druk stoom (hoge P, hoge T) naar lage druk en temperatuur wordt een deel van de enthalpie van deze stoom omgezet in arbeid W.
• condensatie: de enthalpie van de afgewerkte stoom wordt verder verlaagd door warmteafgifte aan het koelwater.
• compressie: verhoging van de enthalpie van het water door toevoer van arbeid via een (hoge-druk) pomp. De druk van het water neemt hierdoor toe.
De hierboven gegeven beschrijving geeft het principe weer van een elektriciteitscentrale. Het daadwerkelijke ontwerp van een moderne elektriciteitscentrale met alleen een stoomcyclus is complexer. In werkelijkheid kent het systeem bijvoorbeeld meerdere kwaliteiten stoom (p,T). Optimalisatie van het ontwerp vraagt dan om de keuze van enerzijds het aantal trappen in de stoomturbine en de bijbehorende temperatuur- en drukniveaus en anderzijds om verschillende warmtewisselaarsecties in het fornuis.
Beschrijving van een elektriciteitscentrale met (ook) een gasturbine
De eerste elektriciteitscentrales gestookt op aardgas hadden aanvankelijk hetzelfde systeemontwerp als de (steenkool)centrales met alleen een stoomcyclus, waarbij aardgas net als een vaste brandstof zoals steenkool of biomassa wordt verbrand in het fornuis om stoom te produceren waarmee een stoomturbine en generator aangedreven worden. In de jaren '60 van de vorige eeuw deed echter een nieuwe techniek zijn intrede in elektriciteitscentrales: de gasturbine.
Gasturbine
De gasturbine is afgeleid van de turbinemotor van een vliegtuig (zoals bekend van straalvliegtuigen). Een gasturbine-eenheid bestaat uit:• een compressor: verbrandingslucht wordt aangezogen en gecomprimeerd
• een verbrandingskamer: hierin worden brandstof en lucht gemengd en verbrand waarbij een sterke volumevergroting en temperatuurverhoging optreedt
• een expansieturbine: waarin een deel van de energie die is vrijgekomen tijdens de verbranding wordt omgezet in arbeid.
Aardgas wordt meestal al op druk aangeleverd. Typisch werkcondities van een gasturbine-eenheid zijn 10-16 bar en 1200 °C in de verbrandingskamer en 1 bar en 500 °C van de uitlaatgassen. Gasturbines hebben elektrische vermogens van 1-375 MW. Het elektrisch rendement van gasturbine-installaties bedraagt zo'n 20 tot 35%.
Zoals de naam al aangeeft, werkt een gasturbine-eenheid op gasvormige brandstoffen: aardgas, stadsgas, hoogovengas, biogas, synthesegas, LPG etc. Daarnaast is het, door toepassing van speciale branders en een hoge-druk brandstofpomp, mogelijk om vloeibare brandstoffen te gebruiken die dan als zeer kleine druppeltjes in de verbrandingskamer worden gespoten. Op deze manier is het mogelijk om relatief lichte koolwaterstoffen (benzine, kerosine, huisbrandolie) te gebruiken. Wel dient de gasturbine-eenheid daarop ontworpen te zijn om voldoende verblijftijd in de verbrandingskamer te garanderen. Is dat niet het geval dan zullen deze brandstoffen onvolledig verbranden, met de vorming van grote hoeveelheden roet en koolmonoxide (CO) tot gevolg.
Het rendement van een gasturbine-eenheid is relatief laag en de apparatuur is relatief duur, daardoor is 'stand-alone'-toepassing voor elektriciteitsproductie meestal geen optie. Een uitzondering op deze regel is de toepassing van gasturbine-eenheden voor het opvangen van de piekvraag in het elektriciteitsnet: alle grote elektriciteitsproductiebedrijven hebben wel één of meer gasturbine-eenheden voor dit doel geïnstalleerd. Dit zijn zgn. 'Open Cycle Gas Turbines' (OCGT): de verbrandingsgassen worden na de expansie direct geloosd in de atmosfeer. Deze eenheden maken jaarlijks meestal maar enige tientallen tot honderden draaiuren doordat ze worden ingezet om pieken in de elektriciteitsvraag op te vangen en in te spelen op gunstige prijsschommelingen in de elektriciteitsmmarkt. Daarvoor zijn ze bij uitstek geschikt: een gasturbine-eenheid die op 'stand-by' staat kan in zeer korte tijd op vol vermogen elektriciteit aan het net leveren.
Vanzelfsprekend moeten gasturbine-eenheden voldoen aan alle milieu-eisen om luchtverontreiniging (met name NOx- en CO-uitstoot) te beperken, en zullen er voorzieningen moeten zijn om de restwarmte in de uitlaatgassen op een verantwoorde manier in de atmosfeer te lozen.
Moderne gascentrale
De ontwikkeling van grote, betrouwbare gasturbines bood de mogelijkheid om gasturbine-eenheden te integreren in de conventionele gascentrales (waarbij aardgas net als een vaste brandstof verbrand wordt om stoom te produceren). De gasturbine-eenheid wordt bij deze gasgestookte combi-eenheden gebruikt om de verbrandingslucht voor het fornuis van de conventionele gascentrale te leveren. In de jaren '80 van de vorige eeuw zijn zo de bestaande aardgascentrales in Nederland aangepast, waarbij een rendementsverbetering van zo'n 4% werd bereikt en het elektrisch rendement op zo'n 40 tot 45% uitkomt.Deze configuratie is mogelijk omdat een gasturbine-eenheid werkt met een grote overmaat verbrandingslucht. Dit betekent dat in de uitlaatgassen van een gasturbine nog veel zuurstof aanwezig is, meestal zo'n 10-12 vol.%, wat ruim voldoende is om in het nageschakelde fornuis nog eens een hoeveelheid brandstof om te zetten en met de vrijkomende warmte stoom te produceren. Deze hoge-drukstoom wordt vervolgens net als in een conventionele centrale naar een stoomturbine/generator-combinatie geleid om elektriciteit op te wekken.
Tegenwoordig wordt voor nieuw ontworpen aardgascentrales bijna zonder uitzondering het STEG (SToom En Gasturbine)-principe gebruikt, waarbij er voor de stoomcyclus geen extra brandstof meer wordt verbrand maar de hete uitlaatgassen van de gasturbine rechtstreeks worden gebruikt om stoom te produceren. Deze STEG-centrales halen elektrische rendementen van 55 tot 60%.
De Eemscentralew combineert beide systeemconcepten. In 1988 werd een bestaande aardgasgestookte eenheid aangepast door plaatsing van een aan het fornuis voorgeschakelde gasturbine-eenheid. Deze combi-eenheid heeft daarmee een vermogen van 675 MWe. In 2001 zijn vijf moderne STEG eenheden van elk 350 MWe in bedrijf gekomen. Met een gasturbine-eenheid van 17 MWe brengt dit het totale elektrisch vermogen van de centrale op 2442 MWe.