Grensvlak
Als twee stoffen, A en B, met elkaar in contact zijn, en een derde stof, X, bevindt zich zowel in A als in B, dan zal X zich van de ene stof naar de andere bewegen totdat er een evenwicht optreedt. Maar in tegenstelling tot bij warmte, waar evenwicht betekent dat de temperatuur overal hetzelfde is, hoeft in dit geval in de evenwichtssituatie de concentratie van X in A ($C_A$) niet hetzelfde te zijn als de concentratie van X in B ($C_B$).
Een voorbeeld: water en lucht zijn met elkaar in contact, en in beide bevindt zich zuurstof. De zuurstofconcentratie in lucht is 0,278 kg/m³, maar in het water is deze, als er evenwicht is, slechts 0,0093 kg/m³. Ondanks het concentratieverschil van zuurstof tussen water en lucht, is er bij deze concentraties geen zuurstofstroom. (Er bewegen zich uiteraard wel zuurstofmoleculen van het water naar de lucht en omgekeerd, maar de netto stroom is nul.)
Dit verschijnsel, de mogelijkheid van een concentratieverschil zonder flux, is het belangrijkste verschil tussen stoftransport en warmtetransport. De differentiaalvergelijking die stoftransport beschrijft, heeft dezelfde vorm als die van warmtetransport, dus ook de oplossingen komen overeen. Dat zullen we hierna zien.
Verdelingscoëfficiënt
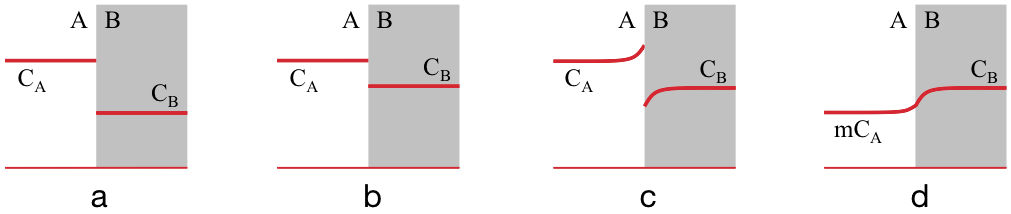
Stel dat een stof X zich in evenwicht in twee stoffen A en B bevindt, met concentratie $C_A$ hoger dan $C_B$, zoals in figuur 1a. Wordt $C_B$ nu hoger (1b), dan bevindt er zich dus eigenlijk teveel van X in B. X zal dan van B naar A gaan stromen (1c), dus schijnbaar "tegen het concentratieverschil in".
Maar als we weten dat in evenwicht geldt dat $C_B/C_A = 0,5$, dan kunnen we $C_A$ met deze waarde vermenigvuldigen om een plaatje te krijgen dat wel een continue concentratie laat zien (1d). Deze verhouding van concentraties in evenwicht heet de verdelingscoëfficiënt, $m$. Met deze coëfficiënt kunnen concentraties aan beide zijden van het grensvlak in elkaar omgerekend worden.
Henry
Hoe bepalen we de verdelingscoëfficiënt? Het probleem is dat we hier steeds te maken hebben met een combinatie van drie stoffen. Voor veelvoorkomende combinaties zijn wel gegevens te vinden, maar er moeten maar net metingen gedaan én gepubliceerd zijn.
Voor de combinatie van een gas en een vloeistof (zoals in het voorbeeld van zuurstof hierboven) zijn heeft de Brit William Henryw (1774-1836) in 1803 de volgende wet vastgesteld (WP2014): "At a constant temperature, the amount of a given gas that dissolves in a given type and volume of liquid is directly proportional to the partial pressure of that gas in equilibrium with that liquid." Ofwel:
$$p = H·x$$ waarin
• p de partiële druk van de betreffende stof in de gasfase [Pa]
• x de molfractie van de stof in de vloeistof [mol/mol]
• H de constante van Henry [Pa]
TPDC-137 geeft voor de combinatie van water met tien gassen de constante van Henry bij verschillende temperaturen.
De partiële druk van een gas is de bijdrage van dat gas aan de totale druk. Volgens de ideale gaswet is de partiële druk gelijk aan de volumefractie van het gas in het totale mengsel, vermenigvuldigd met de totale druk. Voor zuurstof in lucht bij standaarddruk geldt dus bijvoorbeeld: $p_z$ = 0,2095·1,0·105 Pa.
Meestal hebben we of willen we de concentratie in de vloeistof niet in mol/mol maar in mol/m³ of kg/m³. Dan zullen we dus de omrekening van molx/molwater naar kg/m³ moeten uitvoeren.
De verdelingscoëfficiënt m van een gas x bij een water-lucht-grensvlak (in $({kg}_x/m^3)_L / ({kg}_x/m^3)_W$) kan van de constante van Henry worden afgeleid (met toepassing van pV=nRT):
$$m = 10^{-5}·H·(M_W/M_L)·(ρ_L/ρ_W) = 2,19·10^{-11}·p/T·H$$ waarin $p$ de druk is (in Pa) en $T$ de temperatuur (in K). Deze formule geldt voor concentraties van x waarvoor de dichtheid van het gas-lucht-mengsel niet significant van die van lucht afwijkt.
Aan het grensvlak met een zuivere stof is de concentratie in het aangrenzende medium gelijk aan de verzadigingsconcentratie van die zuivere stof in dat medium. Voor waterdamp in lucht direct boven een water- of ijsoppervlak is de partiële druk gelijk aan de dampspanning (TPDC-107-112).
Vraagstukken
Methaan
De onderste laag van de atmosfeer bevat 2,2·10-4 volumeprocent methaan.Hoeveel bedraagt de methaanconcentratie in water die hiermee in evenwicht is (in kg/m³)?
⬇ antwoord
$H$ = 3,8 GPa (20°C) (een andere temperatuur mag uiteraard ook) ⇒ $x$ = 1·105·2,2·10-6/3,8·109 [volumeprocent!] = 5,790·10-11 mol/mol;
$M_{CH_4}$/$M_{H_2O}$ = 16/18 ⇒ $C$ = 5,790·10-11·16/18 = 5,147·10-11 kg/kg ⇒ $C_e$ = 5,1·10-8 kg/m³
(ter vergelijking: 2,2·10-6 m³/m³ komt, met $ρ_{CH_4}$ = 0,657 kg/m³, overeen met 1,45·10-6 kg/m³)
$M_{CH_4}$/$M_{H_2O}$ = 16/18 ⇒ $C$ = 5,790·10-11·16/18 = 5,147·10-11 kg/kg ⇒ $C_e$ = 5,1·10-8 kg/m³
(ter vergelijking: 2,2·10-6 m³/m³ komt, met $ρ_{CH_4}$ = 0,657 kg/m³, overeen met 1,45·10-6 kg/m³)
Bronnen
WP2014, http://en.wikipedia.org/wiki/Henry's_LawwLaatste wijziging: 12-10-2022

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.