Toestandsdiagrammen
Toestandsdiagrammen zijn erg behulpzaam bij het analyseren van processen aangezien ze gebruikt kunnen worden om de hoeveelheden warmte en arbeid die uitgewisseld worden tussen systeem en omgeving te visualiseren. Voorbeelden van toestandsdiagrammen zijn p,V-, T,S- en H,S-diagrammen.
p,V-diagram
Het p,V-diagram is al eerder genoemd bij fasediagrammen. In onderstaande figuur is weergegeven hoe een ideaal gas isotherm expandeert van punt A naar punt B. Zowel aan het verloop van de lijn als aan de formule die erbij staat, is te zien dat het bij een isotherm om een omgekeerd evenredig verband tussen druk en volume gaat. De door het gas verrichte arbeid tijdens de expansie is in de figuur weergeven met het gekleurde oppervlak.
P,V-diagram van een ideaal gas dat isotherm expandeert van punt A naar punt B (bron: Wikimedia Commons)
De hoeveelheid arbeid die het gas verricht kan worden berekend met de formule: $$ W_{A→B} = {∫_{A}^{B} p \dV $$
T,S-diagram
Voor het zichtbaar maken van hoeveelheden warmte en arbeid zijn T,S-diagrammen bruikbaar. In het T,S-diagram van onderstaande figuur is een willekeurige omkeerbare (reversibele) thermodynamische cyclus afgebeeld waarbij de temperaturen liggen tussen TH en TC en de entropiewaardes tussen SA en SB. Onder de aanname dat het proces arbeid verricht (en het kringproces dus rechtsom verloopt), is het oppervlak binnen de kromme gelijk aan deze hoeveelheid arbeid en is het oppervlak QC gelijk aan de hoeveelheid warmte die overgedragen wordt van het systeem naar de omgeving. Het totaal van beide oppervlakken is de opgenomen hoeveelheid warmte QH.
H,S-diagram
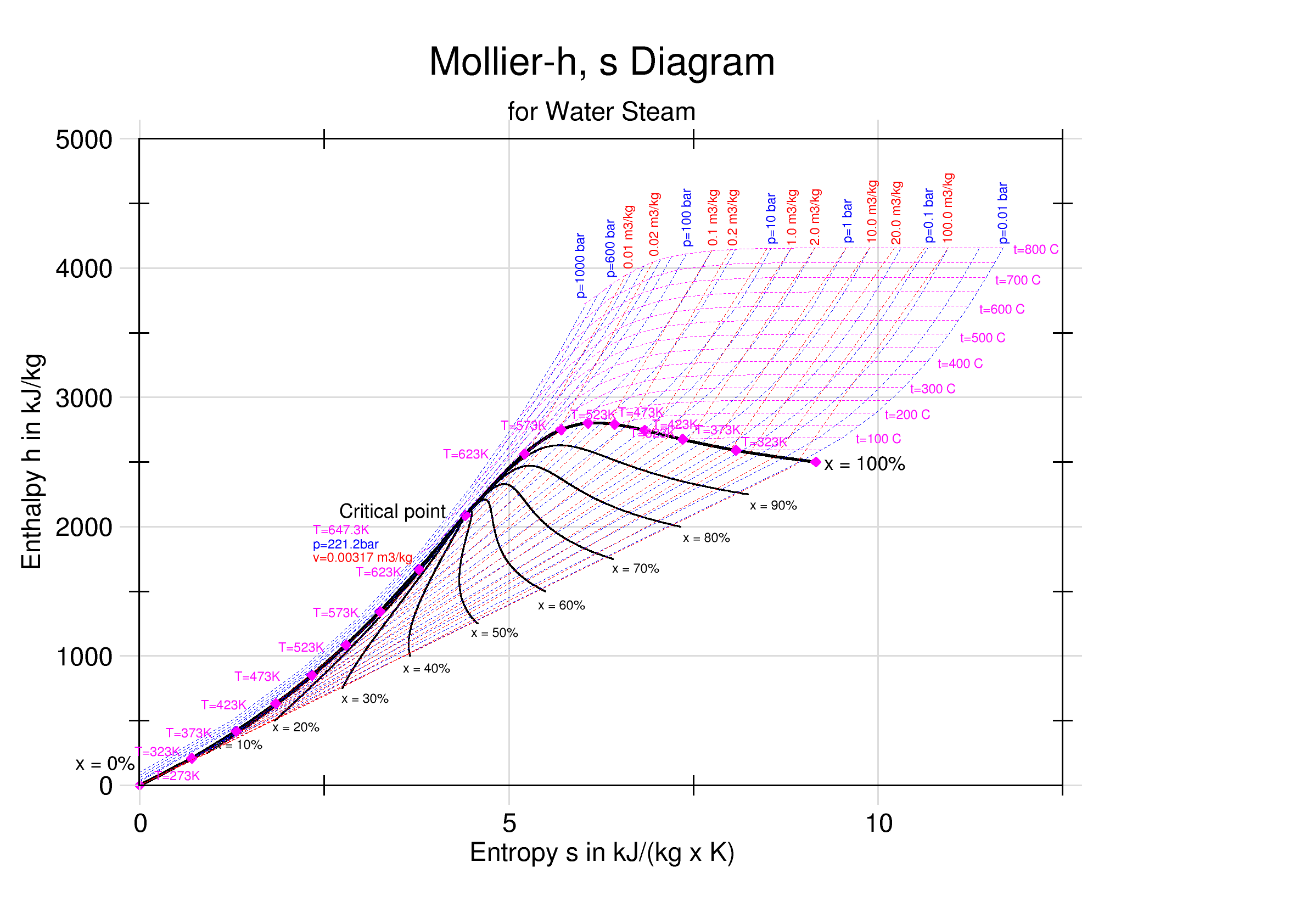
H,S-diagrammen worden vooral gebruikt voor stoom/watersystemen. Het H,S-diagram wordt ook wel een Mollier-diagram genoemd, naar de bedenker R. Mollier. Onderstaande figuur laat het Mollier-diagram voor water/stoom zien. In de figuur zijn isobaren, isothermen en lijnen met constante dampfracties (aangeduid met x) aangegeven. In het gebied omsloten door de dikke zwarte golvende curve zijn vloeistof en damp met elkaar in evenwicht en zijn de isobaren en isothermen aan elkaar gelijk.
Adiabatisch, reversibel en isentropisch
Bij kringprocessen is er vaak sprake van adiabatische processen en ook bij de berekening aan toestandsveranderingen wordt regelmatig aangenomen dat een toestandsverandering adiabatisch, reversibel en/of isentropisch verloopt. Wanneer een proces adiabatisch verloopt wil dat zeggen dat er geen warmte-uitwisseling met de omgeving is. Een proces dat niet alleen adiabatisch verloopt maar ook omkeerbaar (reversibel) wordt een isentropisch proces genoemd, m.a.w. de entropiewaarde blijft gelijk. Een isentropisch proces verloopt in een T,S- of H,S-diagram dus langs een verticale lijn.
Laatste wijziging: 08-11-2023

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.