Verzuring van de oceanen
De verzuring van de oceanen wordt door de WBGU (2006) uitgebreid beschreven in het rapport The Future Oceans - Warming Up, Rising High, Turning Sourw. De informatie op deze pagina is grotendeels gebaseerd op dit rapport.
Een consequentie van het feit dat regen van nature CO2 bevat in de vorm van (opgelost) waterstofbicarbonaat HCO3- is dat er met regen CO2 wordt gedeponeerd in de oceanen. Ook wordt CO2 opgenomen aan het oppervlak van de oceanen. Door stroming, wervelingen, wind en golven wordt uiteindelijk ook het diepere oceaanwater verrijkt met CO2. De oceanen bevatten ook basische stoffen, interacteren met bodem, ontvangen geërodeerd materiaal etc. Van nature stelt zich zo een evenwicht in, de pre-industriële pH van de oceanen bedroeg 8,18 en is dus licht basisch.
De zuurgraad van zeewater is afhankelijk van de CO2-concentratie, wat te zien is in onderstaande evenwichtsvergelijking. Een verhoogde atmosferische CO2-concentratie zorgt namelijk voor een verschuiving van het evenwicht richting het lichtzure waterstofbicarbonaat (HCO3-).
CO2 + H2O + CO32- ↔ 2 HCO3-
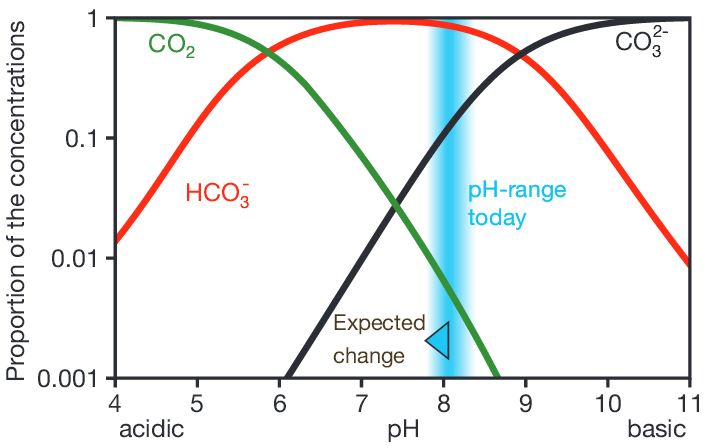
In de oceanen is het aandeel CO2 ca 1%, dat van HCO3- 91% en CO32- 8%. In onderstaande figuur is dit weergegeven. De pijl in de blauwe band geeft aan hoe de pH (en de concentraties in het carbonaatevenwicht) verandert als de atmosferische CO2-concentratie toeneemt naar 750 ppm (nu ca. 400 ppm).
Sinds het begin van de industriële revolutie is naar schatting de helft van de hoeveelheid CO2 uitgestoten door verbranding van fossiele brandstoffen, of een derde van de totale (verbranding plus verandering landgebruik) hoeveelheid uitgestoten CO2, in de oceanen opgenomen: tussen 1800 en 1995 een hoeveelheid van 118 ± 19 Gton koolstof. Dit heeft geleid tot een gemiddelde daling van de pH van de oceanen met 0,11, ofwel een toename van H+ met 30%.
De daling van de pH doet zich vooral voor aan het oppervlak van de oceanen en in de ondiepere gedeelten. Wetenschappers hebben vastgesteld dat het pH-signaal zich manifesteert tot ca. 1000 m diepte, in de Noord-Atlantische trog tot 3000 m diepte.
Een dalende pH is schadelijk voor het oceaanleven. In eerste instantie betreft dit koraalriffen: zij bouwen hun skelet op uit kalk. Als het water warmer en zuurder wordt gaat dit steeds moeilijker, doordat de hoeveelheid carbonaat (CO32-) in het zeewater afneemt. In 2009 is in Science een studie gepubliceerd naar de groei van koraalriffen in het Great Barrier Reef. Volgens de onderzoekers is deze sinds 1990 met 14% afgenomen (persbericht AIMSw).
Koraalriffen bouwen het calciumcarbonaat in aragoniet, een kalkmineraal met een iets andere kristalstructuur dan calciet, in. Als de carbonaatconcentratie in zeewater lager wordt dan 66 µmol/l dan is de vorming van aragoniet fysiologisch niet meer mogelijk en is het zeewater onderverzadigd voor de vorming van koraalriffen en kalkskeletten van schelpdieren. In de zuidelijke oceaan is het zeewater op sommige plaatsen al gevaarlijk arm aan carbonaat, nl. 105 µmol/l. Als de CO2-uitstoot niet vermindert, verwachten wetenschappers dat een groot deel van de zuidelijke oceanen de kritische grens voor schelpdier- en koraalgroei rond 2050 bereikt.
Bronnen
WBGU (2006), German Advisory Council on Global Change (WBGU) (2006). The Future Oceans - Warming Up, Rising High, Turning Sour, Special Report, Berlin.Laatste wijziging: 12-10-2022

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.