Energiesysteemanalyse: voorbeeld ammoniakfabriek
Ammoniak, NH3, wordt wereldwijd op grote schaal geproduceerd als grondstof voor kunstmest. De uitvinding van het Haber-Bosch-proces (1908) voor de synthese van ammoniak uit stikstof was een doorbraak die relatief goedkope productie van stikstofkunstmest mogelijk maakte en in de decennia daarna heeft geleid tot sterke productiviteitsverhoging van de landbouw.
Ammoniak heeft een stookwaarde (LHV) van 19,9 MJ/kg. In een ammoniakfabriek wordt ammoniak gemaakt uit methaan CH4 en lucht. De volgende overall-reactie treedt op:
2 CH4 + N2 + 2 1/2 O2 → 2 NH3 + 2 CO2 + H2O
In het daadwerkelijke proces wordt eerst synthesegas gemaakt uit methaan met lucht, daaruit wordt CO2 verwijderd zodat een mengsel van N2 en H2 ontstaat dat kan reageren tot NH3. Deze laatste stap is het Haber-Bosch-procédé.
Vraag:
Als de stookwaarde (LHV) van methaan 50 MJ/kg bedraagt en aangenomen wordt dat er verder geen verliezen optreden, hoeveel warmte wordt er dan in de fabriek geproduceerd?
Het antwoord kan bepaald worden met een energiebalans. Wanneer aangenomen wordt dat de fabriek continu produceert geldt er:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = 0 $$
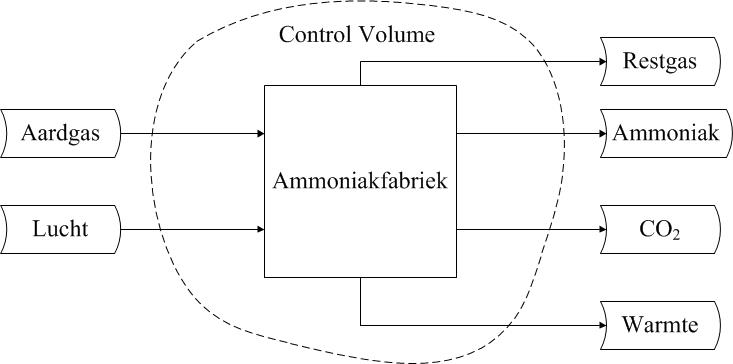
Een inventarisatie van alle stromen (zie onderstaande figuur):
• inputs: methaan, lucht
• outputs: ammoniak, CO
Lucht, CO
$$ Q = φ_{\m,\methaan} · LHV_{\methaan} - φ_{\m,\ammoniak} · LHV_{\ammoniak} $$
Uit de reactievergelijking volgt dat er 1 mol NH3 per mol CH4 ontstaat. De molgewichten van methaan en ammoniak zijn respectievelijk ongeveer 16 en 17 g/mol, dus per kg geproduceerd ammoniak is er 16/17 kg methaan nodig en er geldt:
$$ φ_{\m,\methaan} = 16/17 · φ_{\m,ammoniak} $$
De geproduceerde hoeveelheid warmte per kg ammoniak is dan:
$$ {Q}/{φ_{\m,\ammoniak}} = 16/17 · LHV_{\methaan} - LHV_{\ammoniak} = {16}/{17} · 50 - 19,9 = 27,2 {\MJ}/{\kg \ammoniak} $$
In de fabriek ontstaat per kilogram ammoniak dus 27,2 MJ warmte(!). Of deze warmte nuttig kan worden benut hangt af van de inrichting van het industriële proces, de stand der techniek én of er potentiële gebruikers van deze warmte zijn op niet al te grote afstand van deze fabriek (wat meestal binnen een straal van 10 tot 25 km betekent).
Laatste wijziging: 12-10-2022

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.

Deze publicatie valt onder een Creative Commons licentie. Zie hiervoor het colofon.