Analyse van energiesystemen
Deze website vormt het eerste deel van het webdictaat voor het vak TB142E Analyse van energiesystemen, behorende bij de opleiding Technische Bestuurskunde aan de TU Delft, in het collegejaar 2024-2025. Dit webdictaat kan het beste worden bekeken met de browsers Chrome, Safari en evt. (afhankelijk van het besturingssysteem) ook Firefox. Deel 2 van het webdictaat, over de lesstof voor deel 2 van het vak, is nog niet compleet. De latere delen volgen zsm.
Het dictaat kan op meerdere manieren worden bestudeerd:
• per college: in het menu links staat een overzicht van het dictaat ingedeeld per college. Voor elk college staat daar een link naar de beginpagina van dat college en een overzicht met de pagina's van het webdictaat die relevant zijn voor het betreffende college.
• alles op één pagina: er is een printbare versie waarin alle pagina's in collegevolgorde zijn opgenomen.
• naar eigen inzicht: links in het menu is een zoekfunctie.
Voor contactinformatie en referenties, zie het colofon.
Voor meer informatie over dit vak:
Brightspacew
Studiegidsw
Op- en aanmerkingen zijn van harte welkom: l.stougie@tudelft.nl.
Heel veel plezier en succes met het bestuderen van het webdictaat.
Met vriendelijke groet,
Lydia Stougie, modulemanager.
Colofon
Dit webdictaat is een bewerking van en uitbreiding op het dictaat TB142Ea, Analyse van Energiesystemen, versie 1.0, studiejaar 2013-2014, geschreven door Gerard P.J. Dijkema en Émile J.L. Chappin.
Editor:
dr.ir. Lydia Stougie
Contactinformatie: l.stougie@tudelft.nl.
Auteurs:
dr.ir. Lydia Stougie
dr.ir. Gerard P.J. Dijkema
dr.ir. Émile J.L. Chappin
Copyright © 2025 TU Delft, L. Stougie (ed.) en de auteurs. Tenzij anders vermeld is alles in deze publicatie gelicenseerd onder een Creative Commons Naamsvermelding GelijkDelen 4.0. Kijk op deze licentiepaginaw voor een volledige tekst van de licentie.

Refereren
Algemene referentie:Stougie, L. (ed.) (2025) Webdictaat Analyse van energiesystemen, http://eduweb.eeni.tbm.tudelft.nl/TB142E.
Referentie naar een specifieke pagina:
Paginatitel, in: Stougie, L. (ed.) (2025) Webdictaat Analyse van energiesystemen, http://eduweb.eeni.tbm.tudelft.nl/TB142E/pagina.
Disclaimer
Hoewel de auteurs van dit webdictaat de uiterste zorgvuldigheid hebben betracht, aanvaarden de auteurs en de uitgever geen enkele aansprakelijkheid voor eventuele fouten en onvolkomenheden, noch voor de gevolgen daarvan.Pagina's in collegevolgorde
In onderstaande tabel staan de beginpagina's voor de colleges in het collegejaar 2024-2025, onder voorbehoud van wijzigingen.
| Week | maandag | dinsdag | woensdag | donderdag | vrijdag |
| 1 | Pasen | uitgeroosterd | |||
| 2 | Introductie energiesystemen | Thermische centrales | Werkcollege | ||
| 3 | Bevrijdingsdag | Energie en energieconversie | Toestandsgrootheden en reacties | ||
| 4 | Werkcollege | Energiesysteemanalyse | |||
| 5 | Werkcollege | Tentamen 1 (wk 1-5) | |||
| 6 | Kerncentrales | Luchtverontreiniging en hydrologische kringloop | |||
| 7 | Energiebalans aarde en koolstofkringloop | Werkcollege | |||
| 8 | Pinksteren | Energieopslag | Levenscyclusanalyse | ||
| 9 | Werkcollege | Afronding en vooruitblik, Vragencollege | |||
| 10 | Tentamen 2 (wk 1-10), Hertentamen 1 | ||||
| +3 | Hertentamen 2 |
De diverse pagina's zijn onderling sterk verbonden. Om zeker te weten welke pagina's bij welk tentamen worden getoetst, staat hieronder een weekindeling van de pagina's.
Week 2: Introductie energiesystemen
energiesystemenenergiesystemen-voorbeeld-elektriciteitsnet
systeembenadering-stappen
systeembenadering-voorbeeld-elektriciteitscentrale
systeembenadering-controle-eenheden
Week 2: Thermische centrales
thermische-centralesthermische-centrales-fossiele-grondstoffen
thermische-centrales-AVI
thermische-centrales-CSP
massabalans
massabalans-fabrieken
massabalans-verblijftijd
chemische-reacties
chemische-reacties-mol
chemische-reacties-moleculen
Week 3: Energie en energieconversie
energievormenenergiebehoudswet
energieconversie
energieconversie-voorbeeld-CV-installatie
energieconversie-warmte-elektriciteit
warmtecapaciteit
thermische-centrales-koeling
Week 3: Toestandsgrootheden en reacties
toestandsgroothedenenthalpie-reactie
enthalpie-reactie-LHV
enthalpie-wet-van-Hess
enthalpie-vorming
Week 4: Energiesysteemanalyse
energiesysteemanalyseenergiesysteemanalyse-voorbeeld-datahotel
energiesysteemanalyse-voorbeeld-ammoniakfabriek
energierendement
energierendement-WKC
energiesystemen-elektriciteitscentrale-alleen-stoomcyclus
energiesystemen-elektriciteitscentrale-met-gasturbine
Week 6: Kerncentrales
kerncentraleskernreacties
atomen
isotopen
Week 6: Luchtverontreiniging en hydrologische kringloop
luchtluchtverontreiniging
luchtverontreiniging-secundair
fotochemie
ozonlaag-afbraak
zure-regen
zwaveluitstoot-natuurlijk
zwaveluitstoot-industrie
zure-regen-verwering
zure-regen-oceanen
hydrologische-kringloop
hydrologische-kringloop-subkringlopen
hydrologische-kringloop-verschillen
hydrologische-kringloop-zoet-water
hydrologische-kringloop-grondwater
waterketen
watergebruik
watergebruik-zoet
watergebruik-duurzaam
Week 7: Energiebalans aarde, koolstofkringloop
klimaatsysteemklimaatmodellen
energiebalans-aarde
energiebalans-aarde-instraling-zon
energiebalans-aarde-reflectie-zonlicht
energiebalans-aarde-warmtestraling
energiebalans-aarde-broeikaseffect
energiebalans-aarde-broeikasgassen
energiebalans-aarde-atmospheric-window
energiebalans-aarde-broeikaseffect-versterkt
energiebalans-aarde-broeikasgassen-GWP
energiebalans-aarde-radiative-forcing
klimaatsysteem-koppelingen
koolstofkringloop-langzaam
koolstofkringloop-snel
koolstofkringloop-CO2-concentratie
klimaatsysteem-koppelingen-koolstofkringloop
klimaatverandering
klimaatverandering-oplossingsrichtingen
Week 8: Energieopslag
energieopslagenergieopslag-vormen
energieopslag-kenmerken
energieopslag-voorbeelden
Week 8: Levenscyclusanalyse
levenscyclusanalyselevenscyclusanalyse-standaardprocedure
levenscyclusanalyse-eco-indicator-95
levenscyclusanalyse-eco-indicator-99
levenscyclusanalyse-recipe
levenscyclusanalyse-software-database
levenscyclusanalyse-kanttekeningen
levenscyclusanalyse-verwante-methodes
Week 9: Afronding en vooruitblik
energievoorziening-toekomstExterne bronnen die onderdeel zijn van de leerstof
In het dictaat zijn externe bronnen opgenomen die onderdeel zijn van de leerstof. Deze pagina geeft een overzicht van deze externe bronnen.
Week 6 - Kerncentrales
• Werking en onderdelen moderne kerncentralesw• Toekomstige kerncentralesw
Week 8 - Energieopslag
• Bij dit onderwerp hoort het artikel Hadjipaschalis et al. (2009), dat te downloaden is via deze linkw (vanaf TU Delft-computers). Het is niet de bedoeling alle feiten te kennen, maar wel de globale eigenschappen van de opslagmedia, en de relatieve positie van de technieken in figuur 10.Introductie energiesystemen
Aan de basis van de analyse van een groot aantal TB-vraagstukken staat systeemdenken, cq. een systeembenadering. Staat in andere modules het systeem van netwerk van actoren en hoe die handelen centraal, in TB142E gaat het om de fysieke, technologische systemen voor de energievoorziening en om het natuurlijke systeem waarin wij leven, waaraan we grondstoffen onttrekken en afvalstoffen teruggeven.
De analyse van 'man-made' systemen en hun relatie met de omgeving - het natuurlijk milieu - wordt in TB142E in een geïntegreerde systeembenadering behandeld. Wat is nu die systeembenadering die zijn wortels heeft in de procestechnologie, toegepaste thermodynamica en systeemtheorie? Waarom is deze zo geschikt om kennis uit chemie, milieukunde en technologische systemen te integreren? En om techniek, bestuur en management in de opleiding TB en het onderzoek aan de faculteit TBM met elkaar te verbinden?
Voorbeelden van energiesystemen zijn:
• Een elektriciteitscentrale. Deze zet brandstof en lucht om in elektriciteit, rookgas en restwarmte. Elektriciteitscentrales zijn groot, het terrein van bijvoorbeeld de Eemscentrale in Groningen beslaat enkele hectares. Centrales staan op een vaste plek, en bestaan uit verschillende subsystemen, die weer opgebouwd zijn uit vele systeemelementen, apparaten, waar weer duizenden onderdelen in zitten.
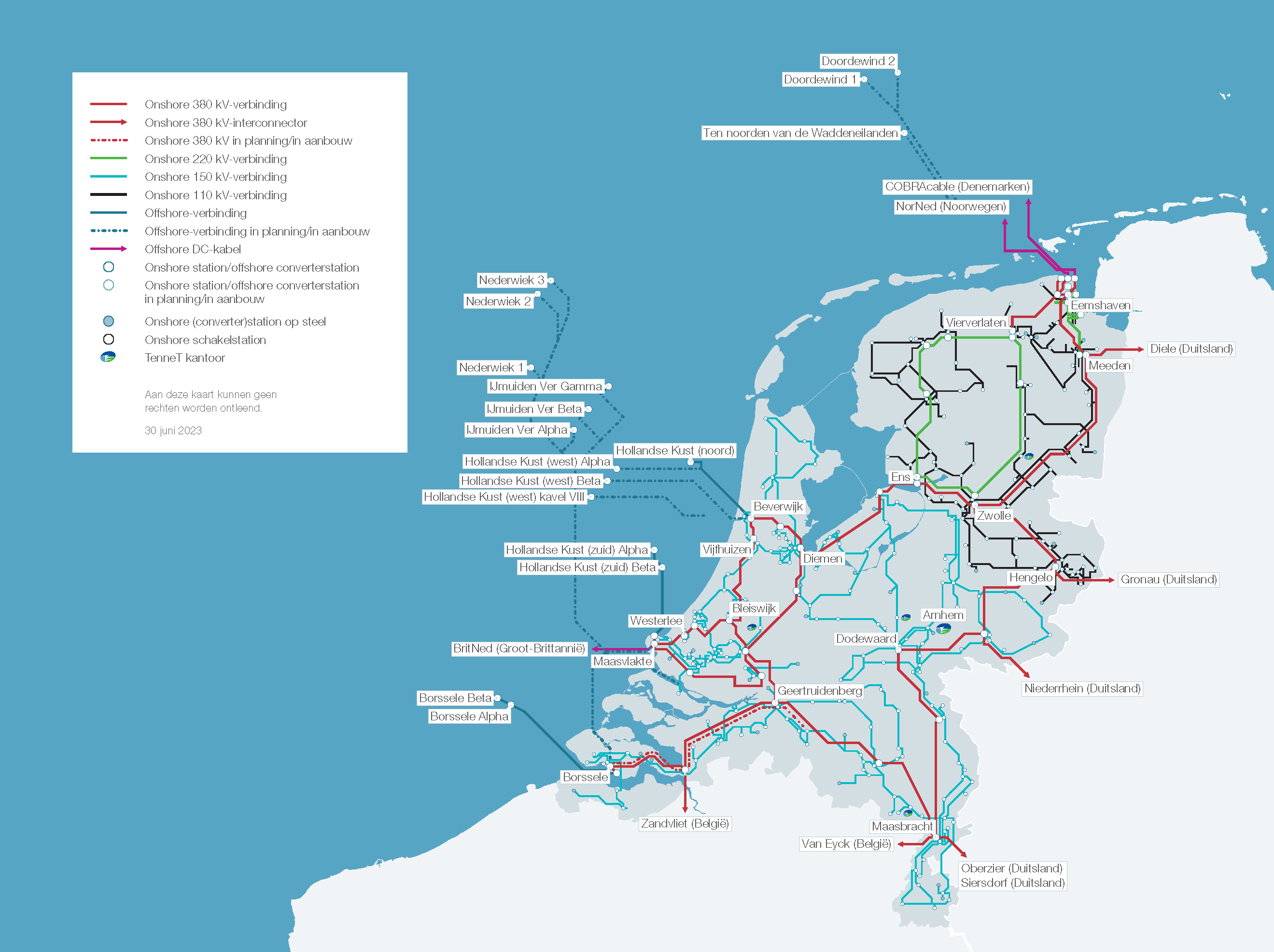
• Het landelijke elektriciteitsnet waarvan een elektriciteitscentrale onderdeel is. Dat is een systeem met centrales, transformatorstations en hoogspanningsleidingen als systeemelementen. Op haar beurt maakt het Nederlandse elektriciteitsnet deel uit van het Europese netwerk - het is daarmee verbonden via zogenaamde interconnectoren.
• Aardgascentrales zijn aangesloten op het landelijke aardgasnet. Het elektriciteitsnet en haar systeemelementen zijn op verschillende manieren verbonden met de fysieke, natuurlijke omgeving: ze gebruiken lucht, en stoten rookgas uit; ze onttrekken koelwater en geven dat opgewarmd weer terug aan meer, rivier of Noordzee, of aan de atmosfeer als waterdamp dat de koeltoren verlaat. Terwijl dit lokale fysieke verbindingen met de omgeving zijn, kunnen de negatieve effecten zich op een ander, hoger schaal- of systeemniveau manifesteren. Het bekendste voorbeeld daarvan is ongetwijfeld de broeikaswerking van CO2 en daarmee samenhangende klimaatverandering. Zwaveluitstoot door centrales, in de vorm van SO2, en NOx veroorzaakt op continentale schaal zure regen, terwijl de uitstoot van roetdeeltjes lokaal en regionaal problemen veroorzaakt.
• Als een auto wordt volgetankt met benzine of diesel, dan wordt er een product gekocht dat voortgebracht is uit een keten van productieprocessen. De 'supply-chain' of voortbrengingsketen voor benzine begint bij de productie van ruwe olie en bestaat verder uit transport, raffinage en afmenging van het product, en distributie naar de tankstations. Verder zijn er systemen ingericht die olieplatforms voortbrengen, het daarvoor benodigde staal produceren etc.
Deze voorbeelden laten zien dat systemen gekenmerkt worden door verschillen in:
• schaalgrootte en systeemniveau
• technische karakteristiek en daaruit voortvloeiende prestatie
• interne complexiteit
• inputs en outputs
• type en functie
Bij een (energie)systeemanalyse kan een algemeen toepasbare procedure gevolgd worden, zie hiervoor de stappen van een (energie)systeembenadering.
Voorbeeld van een energiesysteem: het Nederlands elektriciteitsnet
Het Nederlandse elektriciteitsnet verbindt gebruikers en producenten van elektriciteit. Als goed naar onderstaande figuur wordt gekeken dan kan het elektriciteitsnet als volgt systematisch in beeld worden gebracht.
• Als systeemgrens wordt de grens van Nederland gekozen.
• Het systeem elektriciteitsnet bestaat uit de systeemelementen:
- productie-eenheden:
1. grote elektriciteitscentrales
2. warmtekrachtcentrales
3. overig: afvalverbranders, windparken etc.
- hoogspanningsleidingen beheerd door TenneT, de landelijk netbeheerder van de 380 kV, 220 kV, 150 kV en 110 kV-netten
- eindgebruikers in Nederland: direct aangesloten op het hoogspanningsnet (industriële grootverbruikers) of aangesloten via regionale distributienetten
- interconnectoren waarmee het 380 kV-net is verbonden met het buitenland
- transformatorstations (380 → 220 kV etc.), maar die zijn niet weergegeven in de figuur
• Als het elektriciteitsnet als een fysiek systeem wordt beschouwd waarin centrales onderling en met eindgebruikers zijn verbonden, dan zijn het de verbindingen tussen systeemelementen die structuur aan het systeem geven. Deze hoogspanningsleidingen zijn zelf dus ook systeemelementen.
• Uit bovenstaande figuur kan opgemaakt worden dat de fysieke inputs van het systeem de diverse brandstoffen zijn (aardgas, biomassa, steenkool, uranium) en lucht. De fysieke (of materiële) outputs van het systeem zijn:
- elektriciteit getransporteerd naar de eindgebruikers en over de interconnectoren (bij eindgebruikers wordt de elektriciteit uiteindelijk bijna zonder uitzondering geheel omgezet in restwarmte)
- rookgas met daarin: H2O, CO2, NOx (aardgas, biomassa, steenkool), SO2 en roetdeeltjes (biomassa, steenkool)
- vaste restproducten: bodemas en vliegas, gips (steenkool) en kernafval (kerncentrale)
- warmte die in de centrales wordt weggekoeld met koelwater
• De genoemde inputs en outputs vormen tevens de verbinding tussen het elektriciteitsnet en haar omgeving: er worden brandstoffen aan de aardkorst onttrokken, lucht wordt ingezogen vanuit de atmosfeer en de massa na verbranding wordt als rookgas teruggeven aan de atmosfeer, c.q. opgevangen voor transport naar deponie of hergebruik (o.a. productie van gipsplaten uit rookgasontzwavelingsgips).
• Het systeem waarin de energie-inhoud van de brandstoffen wordt vrijgemaakt, omgezet in elektriciteit en getransporteerd naar de gebruiker kent vier energie-interfaces (outputs) met haar omgeving: energie die de gebruiker bereikt als elektriciteit, energie afgegeven aan het rookgas van de centrales (m.u.v. kerncentrales, zonnepanelen, windturbines), energie afgegeven aan het koelwater van centrales, en elektriciteit die in de hoogspanningsleidingen wordt omgezet in warmte en afgegeven aan de omgeving (netverliezen).
Stappen van een (energie)systeembenadering
Een algemeen toepasbare procedure, die voortborduurt op het stappenplan onderwezen tijdens TB141E, is de volgende:
1. Systeembeschrijving en systeemdiagram
a. Inventariseer de beschikbare informatie in de systeembeschrijving en denk na over het gevraagde. Relateer het vraagstuk aan de inhoudskennis opgedaan in het vak en maak een eerste keuze voor de systeemdecompositie(mogelijkheden):
- géén verdere decompositie, het systeem wordt beschouwd als black-box,
- eerste opdeling in systeemelementen.
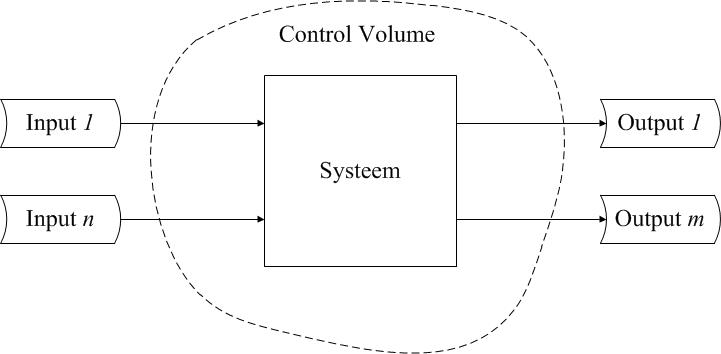
b. Teken, op basis van stap 1a, een (voorlopig) systeemdiagram. Dit is een schematische weergave van het systeem in kwestie dat geschikt is voor het beantwoorden van het gevraagde. In een bruikbaar systeemdiagram is:
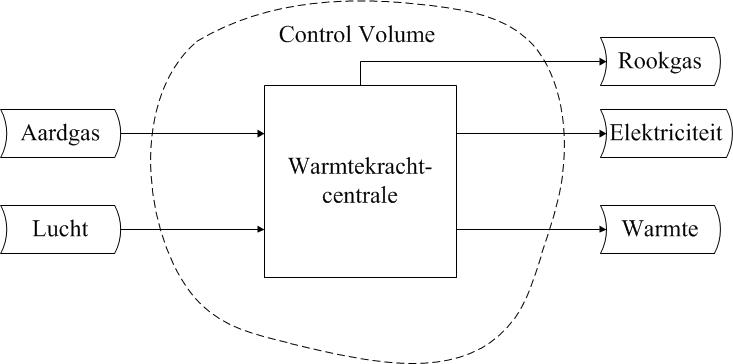
- een zinvolle keuze gemaakt voor de systeemgrens die ook is weergegeven. Daarnaast is de functie (naam) van het systeem vermeld. De systeemgrens bepaalt eveneens het control volume dat gehanteerd wordt voor de analyse (zie onderstaande figuur).
- de beschikbare informatie over alle in- en uitgaande stromen verwerkt, dus zowel de massa- als de energiestromen: deze passeren de systeemgrens;
- ten slotte is indien nodig het systeem verdeeld in onderdelen, systeemelementen of subsystemen.
2. Eerste schatting antwoord. Bepaal naar welke grootheden gevraagd wordt en kies daarbij eenheden. Schat de ordegrootte van de gevraagde grootheden.
3. Oplossingsstrategie. Formuleer een oplossingsstrategie en maak daarbij de benodigde aannames. Welke methoden zijn te gebruiken om de gevraagde grootheden te berekenen?
4. Berekening. Bereken het antwoord op de vraag nu volgens de in stap 3 gekozen strategie. Bij elke berekening dienen de eenheden (dimensies) voor en na het =-teken gelijk te zijn.
5. Controle. Controleer het antwoord. Voldoet het antwoord aan de verwachting, geschat bij stap 2? Voor het uitwerken van vraagstukken is het eerder regel dan uitzondering dat een of enkele iteratieslagen gemaakt worden waarbij delen van de uitwerking worden verbeterd zodat een betere oplossing wordt gevonden. De methode is immers gericht op het structureren van informatie en oplossing.
6. Beantwoording. Beantwoord het gevraagde met vermelding van berekening en eventuele aannames.
De systeembenadering kan bijvoorbeeld worden toegepast op een elektriciteitscentrale.
Toepassing systeembenadering op een elektriciteitscentrale
Het vraagstuk
In de zomer van 2007 is 'Alarmfase Rood' in werking getreden voor de elektriciteitsvoorziening in Nederland. Een dreigend tekort aan productiecapaciteit zou tot regionale of zelfs landelijke storing en netuitval kunnen leiden. In de communiqués van TenneT, de landelijke netbeheerder, werd 'een gebrek aan koelcapaciteit' aangemerkt als oorzaak van de problemen.Watergekoelde elektriciteitscentrales kampten met een absoluut tekort aan koelwater door lage waterstanden én met een te hoge koelwaterinnametemperatuur door de extreme temperaturen. De koelwateruitlaattemperatuur is gelimiteerd op maximaal 30 °C; het temperatuurverschil tussen de koelwaterinlaat en -uitlaat moet minder dan 4 °C bedragen. De hoeveelheid energietoevoer (Q) nodig om 1 cm3 water precies 1 °C op te warmen is gelijk aan 1 Cal (4,2 J).
Zoals ook door de Minister van Economische Zaken is gesuggereerd, is de bouw van koeltorens bij de centrales een mogelijke oplossing ter voorkoming van elektriciteitstekorten in hete zomers. In koeltorens wordt ingenomen water bij ongeveer omgevingstemperatuur verdampt. De daarvoor benodigde verdampingsenergie is ongeveer 40 kJ/mol.
Vragen:
• Verklaar waardoor de hete zomer en de koelwaterrestricties leiden tot een verminderde elektriciteitsproductie. Betrek daarbij de eerste hoofdwet van de thermodynamica en de formule voor het Carnot-rendement, en maak geschikte aannames.
• Bereken een schatting van de hoeveelheid koelwater nodig voor het Nederlandse elektriciteitsproductiepark op een hete tropische dag in augustus. Op zo'n dag wordt gemiddeld over een etmaal een productievermogen van 8000 MW ingezet; het gemiddeld rendement van de stroomproductie is 45%. Bereken een schatting voor:
- een koelwaterinnametemperatuur van 20 °C
- een koelwaterinnametemperatuur van 28 °C
en zet de berekening bij voorkeur zo op dat (met een deel daarvan) ook onderstaande deelvragen beantwoord kunnen worden.
• Licht met een systeemdiagram het verschil tussen de inzet van koeltorens en koelwatersystemen toe.
• Hoeveel water zouden de Nederlandse centrales verdampen op een tropische dag, na installatie van koeltorens?
• Maak een schatting van het capaciteitsverlies van de centrales dat NIET wordt opgeheven door de installatie van koeltorens.
Toepassing van de systeembenadering
Stap 1a: SysteembeschrijvingDoor het gehele vraagstuk te lezen kunnen de betreffende beschrijving en de vragen gekoppeld worden aan de al aanwezige kennis. De contouren van een oplossingsstrategie kunnen zich al vormen. Dan is de eerste stap van de systeembenadering voltooid. Echter, door systematisch stap 1b en 2 uit te voeren wordt vermeden dat al vanaf het begin de verkeerde weg wordt ingeslagen, dan wel dat zaken over het hoofd worden gezien. Dit vereist oefening!
Stap 1b: Systeemdiagram
Er wordt een systeemdiagram gemaakt waarmee in dit geval de energiestromen rond de centrale inzichtelijk worden gemaakt.
• Kies een zinvolle systeemgrens. De systeemgrens wordt gestreept weergegeven indien er sprake is van een open systeem: een systeem dat verbinding heeft met zijn omgeving en dus in- en uitgaande stromen heeft. De systeemgrens geeft hier het terrein van de elektriciteitscentrale weer. Geef van een systeemgrens altijd aan waar die zich bevindt (en wat wel en niet binnen het systeem gerekend wordt). En vermeld de functie (naam) van het systeem.
• Inventariseer alle stromen. In het diagram worden de in- en uitgaande massa- en energiestromen weergegeven door pijlen. Deze moeten altijd worden benoemd. Combineer de gegeven beschrijving en de kennis opgedaan in het vak om na te gaan of er stromen zijn die niet genoemd zijn. Neem deze alsnog op, of maak geschikte aanname(s).
Hoewel een systeemdiagram eenvoudig lijkt, geeft het het nodige overzicht en biedt het veelal inzicht, nodig voor correcte oplossing van vraagstukken uit het domein. Het zelf tekenen van bruikbare diagrammen is niet moeilijk maar vereist wél zelfwerkendheid. Een zekere mate van orde en netheid is gewenst. Meestal volstaat een schema op 'de achterkant van een envelop'. In Angelsaksische engineering curricula wordt van studenten geëist dat ze zgn. 'back-of-the-envelope' berekeningen kunnen maken: met behulp van relatief eenvoudige methoden en hulpmiddelen de essentie van een probleem weergeven en een eerste geschatte oplossing geven. Dat wil dus zeggen: zonder het gebruik van ICT-tools, simulatiemodellen, spreadsheets enz.! Dit is eveneens een van de leerdoelen van TB142E.
Het systeemdiagram voor deze vraag is weergegeven in onderstaande figuur. Het is een vereenvoudigde schematische weergave van een elektriciteitscentrale en kan van pas komen bij de uitwerking van de hierboven gestelde vragen over de elektriciteitscentrale. Hoewel het niet altijd expliciet gevraagd wordt, is het verstandig om altijd een diagram te tekenen. Het tekenen van een diagram dwingt tot gestructureerd denken en geeft overzicht.
Stap 2: Eerste schatting antwoord
Eerst wordt een ruwe schatting gemaakt van het antwoord of tenminste van de verwachte ordegrootte (bijvoorbeeld 30-70% rendement). Dit kan een zeer ruwe schatting zijn, maar door deze schatting te maken kunnen ernstige fouten worden voorkomen.
Stap 3: Oplossingsstrategie
Als een systeemdiagram bekend is, komt de strategie vaak al snel in beeld. Bij de beantwoording van de vraag zal gebruik moeten worden gemaakt van massa- en energiebalansen.
Stap 4: Berekening
Door de opgedane kennis te combineren met de theorie over massa- en energiebalansen kunnen de gevraagde antwoorden worden berekend. Om de vragen afdoende te kunnen beantwoorden is het noodzakelijk veel te oefenen. Daarvoor worden binnen het vak voldoende mogelijkheden geboden.
Stap 5: Controle
Nadat een antwoord is gevonden wordt dit in deze stap vergeleken met de eerdere schatting. Indien er een grote afwijking wordt gevonden, kan bijv. door de eenheden (dimensies) van de berekening te controleren gezocht worden naar de fout. Wordt de fout niet gevonden, merk dan in ieder geval op dat het antwoord niet kan kloppen om aan te geven dat bekend is waarover gesproken wordt en dat er niet zomaar een sommetje wordt opgelost. Waar nodig worden iteratieslagen gemaakt om het antwoord verder te verbeteren.
Voorbeeld van controle van de eenheden (dimensies)
Alhoewel dit taalkundig eigenlijk niet juist is, zijn voor de duidelijkheid alle eenheden in dit voorbeeld tussen vierkante haken gezet.
Vraag: Hoeveel energie levert een continu vermogen van 1,00 [GW] op in [GJ/dag]?
Antwoord:
E = P · τ
P = 1,00 [GW] = 1,00 [GJ/s]
τ = 1 [dag]
E = 1,00 [GJ/s] · 3600 [s/uur] · 24 [uur/dag] = 1,00 · 3600 · 24 · [GJ/s] · [s/uur] · [uur/dag] = 8,64 · 104 [GJ/dag]
en in Joules per dag zou dit zijn:
E = 8,64 · 104 [GJ/dag] · 109 [J/GJ] = 8,64 · 1013 [J/dag]
De eenheid van het antwoord klopt met de vraag. De dagelijkse energiehoeveelheid heeft de eenheid [GJ/dag].
Let op het gebruik van de voorvoegsels M(ega), G(iga) en T(era): door deze te gebruiken kan de berekening in 'engineering' units worden opgeschreven. Bij analyse en ontwerp van industriële systemen en energiesystemen wordt in de praktijk bijna altijd gebruik gemaakt van 'engineering units', getallen uitgeschreven als bijvoorbeeld 1,23 · 10a, waarin a een veelvoud is van 3. Daarmee wordt gevoel gehouden voor de ordegrootte (duizenden, miljoenen, miljarden etc.) en worden vergissingen voorkomen.
Indien de eenheden links en rechts van het gelijkteken niet overeenkomen, kan het zijn dat:
• er een verkeerde formule is gebruikt,
• een formule verkeerd is gebruikt,
• in de uiteindelijke berekening een gegeven niet of verkeerd is opgeschreven.
Thermische centrales
Thermische centrales zijn elektriciteitscentrales die elektriciteit genereren uit warmte. Deze warmte kan op verschillende manieren geproduceerd worden. Een bekende, maar steeds minder toegepaste, manier is de verbranding van fossiele grondstoffen zoals steenkool of aardgas. Kerncentrales behoren ook tot de thermische centrales. Hetzelfde geldt voor elektriciteitscentrales die biomassa of afval (in een afvalverbrandingsinstallatie) verbranden. Of het gaat bijvoorbeeld om zonnewarmte die opgevangen wordt in zonthermische installaties of aardwarmte van voldoende hoge temperatuur.
Bij het vak TB142E wordt ingegaan op de inrichting, werking en analyse van diverse thermische centrales, zoals aardgascentrales, warmtekrachtcentrales (WKC), kerncentrales, zonthermische centrales (Concentrated Solar Power, CSP) en afvalverbrandingsinstallaties (waste-to-energy).
Bij thermische centrales wordt vaak gesproken over het thermisch vermogen van zo'n installatie. Met het thermisch vermogen wordt de hoeveelheid warmtetoevoer bedoeld waarop de installatie ontworpen is. Deze warmtetoevoer is de hoeveelheid warmte die per tijdseenheid vrij zou komen als de toegevoerde brandstof verbrand wordt, m.a.w.: het thermisch vermogen van een installatie is de hoeveelheid brandstof die per tijdseenheid door deze installatie verwerkt wordt maal de stookwaarde van deze brandstof.
Bij het rekenen aan thermische centrales wordt vaak gebruik gemaakt van massabalansen. Ook moet rekening worden gehouden met de chemische reacties die optreden in een thermische centrale.
Fossiele grondstoffen
Fossiele grondstoffen zijn zonder uitzondering mengsels van koolwaterstoffen; ze bevatten zeer veel verschillende organische verbindingen:
• aardgas bestaat hoofdzakelijk uit methaan, maar bevat vaak ook organische verbindingen zoals ethaan, propaan, en anorganische verbindingen zoals zwavelwaterstof (H2S).
• aardolie is een mengsel van tot wel 100.000 verschillende organische verbindingen, van propaan en butaan tot iso-octaan en van benzeen tot zeer complexe organische verbindingen.
• steenkool bevat eveneens zeer veel verschillende organische verbindingen. Typerend voor steenkool is een hoge C/H-verhouding (tot wel 1:0,5).
Wereldwijd worden uit fossiele grondstoffen op grote schaal motorbrandstoffen en zuivere koolwaterstoffen geproduceerd:
• benzine bestaat uit een mengsel van onder andere butaan, pentaan, iso-heptaan, iso-octaan, iso-nonaan, benzeen, tolueen, etc.,
• diesel bestaat uit hogere alkanen, alkenen en aromaten, vanaf dodecaan tot C20, xyleen, naftaleen etc.,
• uit nafta (ruwe benzine) wordt zuiver etheen (ethyleen) en propeen (propyleen) geproduceerd, de bouwsteen van polyetheen (polyethyleen, PE) en polypropeen (polypropyleen, PP),
• uit aardgas wordt methanol geproduceerd, dat zijn weg vindt naar vele toepassingen.
Er zijn veel organische verbindingen die zuurstof (O) bevatten en op grote schaal industrieel worden geproduceerd, zoals methanol (methyl-alcohol, CH3OH), ethanol (alcohol, C2H5OH) en methyl-tert-butyl-ether (MTBE). Ook zijn er veel organische verbindingen met stikstof (N), bijvoorbeeld acrylonitril. De industriële productie van organische verbindingen wordt uitgebreid behandeld in het vak TB243E, Analyse van industriële systemen.
Afvalverbrandingsinstallatie
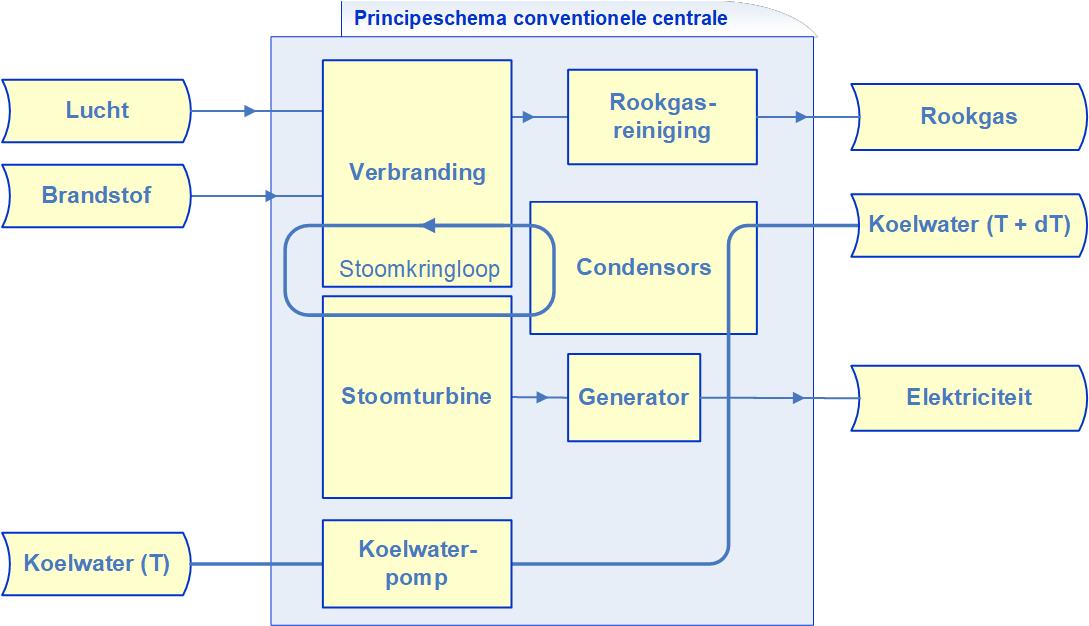
Een afvalverbrandingsinstallatie (AVI) verbrandt allerlei soorten afval en uit de ontstane warmte wordt op dezelfde manier als bij een conventionele centrale, d.w.z. via een stoomcyclus, elektriciteit opgewekt. De ontstane rookgassen worden uitgebreid gereinigd.
Net als een warmtekrachtcentrale produceert een AVI zowel elektriciteit als warmte. De warmte van een AVI gaat naar omliggende gebouwen (woningen, kantoren, fabrieken). De niet-brandbare fractie van het afval wordt o.a. gebruikt als funderingsmateriaal bij de aanleg van wegen en verwerkt in asfalt.
Zonthermische centrales
Zonthermische centrales zijn vaak grootschalige installaties waarbij zonlicht met behulp van spiegels geconcentreerd wordt om water of een ander medium op te warmen. Dit zijn de Concentrated Solar Power centrales, kortweg CSP genoemd. De in een CSP geconcentreerde zonnewarmte wordt gebruikt in een klassieke stoomcyclus waarin de warmte wordt omgezet in elektriciteit en restwarmte (die dient te worden weggekoeld).
Er bestaan verschillende uitvoeringsvormen van CSP-installaties, in het vak TB242E, Processen in de energiesector, wordt hier verder op ingegaan. Een van deze uitvoeringsvormen is een zonnetoren. In een veld rond zo'n toren staan honderden tot duizenden spiegels opgesteld die het zonlicht naar de ontvanger op de toren weerkaatsen. Het ontvangende medium is bijvoorbeeld vloeibaar lithium (Li) dat zeer hoge temperaturen kan bereiken, tot boven de 2000 °C. Met de opgevangen warmte kan vervolgens een stoomcyclus worden aangedreven waarmee elektriciteit geproduceerd wordt. Wanneer de ontvanger als opslag van de warmte kan fungeren, kan daarmee ook (een deel van) de nacht worden overbrugd.
Massabalans
Een massa- (of energie)balans wordt opgezet voor een systeem. De "wet van behoud van massa" zegt dat, behoudens atoomkernreacties, de totale hoeveelheid massa gelijk blijft. De hoeveelheid massa die een systeem ingaat minus de hoeveelheid massa die een systeem verlaat is dus gelijk aan de verandering in massa van het systeem, in formulevorm:$$ \Σφ_{\m,\in(i)} − \Σφ_{\m,\uit(j)} = {\d M_{\systeem}}/{\d t} $$
met:
$φ_{\m,\in(i)}$ = ingaande massastroom $i$ [kg/s]
$M_{\systeem}$ = massainhoud systeem [kg]
Massabalans bij open en gesloten systemen
Het opstellen van een balans levert informatie op over een systeem en haar relatie met de omgeving. Dit is slechts mogelijk omdat een systeem alléén gedefinieerd kan worden in relatie tot het universum, m.a.w.: een systeem is een door de gekozen systeemgrens afgezonderd deel van dat Universum.Als gekeken wordt naar de relatie van systeem met haar omgeving zijn er vier typen systemen te onderscheiden:
• gesloten systeem: géén inputs, géén outputs
• open systeem: inputs en outputs
• systeem met slechts inputs
• systeem met slechts outputs
In gesloten systemen is de hoeveelheid massa constant. Een gesloten vat waarin twee reactanten worden gemengd waarna deze wordt afgesloten, is te beschouwen als een gesloten systeem. Na verloop van tijd (de reactietijd) zullen de reactanten volledig gemengd zijn en wellicht (deels) gereageerd hebben tot producten. Omdat het systeem gesloten is, blijft de massa constant.
De twee laatste typen systemen zijn speciale gevallen van open systemen. Als een systeem slechts massa-inputs heeft, dan treedt er onvermijdelijk accumulatie van massa op in het systeem. Denk bijvoorbeeld aan de koeltank van een melkveehouder; deze wordt gedurende drie dagen telkens gevuld met melk afkomstig van de koeien.
Als een systeem slechts outputs heeft, dan vindt er de-accumulatie of depletie van het systeem plaats. Als de koeltank (bijna) vol is, dan wordt ze in korte tijd geleegd door aansluiting op een koeltankwagen van de zuivelcoöperatie. Een aardgasveld dat in productie is gebracht, is gedurende de gebruikstijd een systeem met slechts één output - het geproduceerde ruwe aardgas.
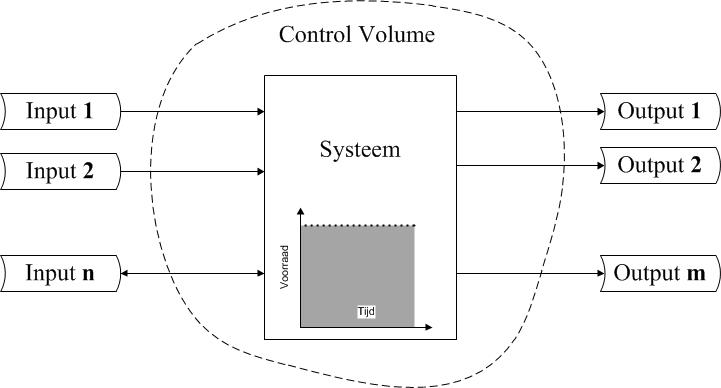
Stationaire systemen
Als er géén verandering van de stromen van een continu werkend systeem optreedt, ΔMsysteem = 0, dan wordt gesproken van een stationair systeem. Voor een open systeem met inputs en outputs treedt dan géén netto accumulatie of depletie op. Dit is schematisch weergegeven in onderstaande figuur.De vergelijking voor de wet van behoud van massa voor een open systeem wordt dan een balansvergelijking:
$$ Σφ_{\m,\in(i)} = Σφ_{\m,\uit(j)} $$
De balansvergelijking zegt dat voor een stationair werkend open systeem de som van de ingaande massastromen gelijk moet zijn aan de som van de uitgaande massastromen.
Voor de uitvoering van een systeemanalyse is deze vergelijking bijzonder handig. Door in de analyse te veronderstellen dat het gaat om een stationair systeem, is het mogelijk ontbrekende informatie af te leiden. Ook kunnen aangeleverde gegevens gecontroleerd worden op juistheid en consistentie.
Tot nu toe is er gesproken over systemen en massabalansen in het algemeen. Alles is een systeem impliceert dat een en ander van toepassing is op grote en kleine systemen, op elk schaalniveau.
De aarde is te zien als een gesloten systeem voor massa; er komt geen massa bij (behoudens meteoren/meteorieten). Ook verliest de aarde geen massa: de zwaartekracht is voldoende om te zorgen dat er via de atmosfeer geen massa verdwijnt naar het heelal. Het Centraal Bureau voor de Statistiek behandelt Nederland als een open systeem voor goederen (en geld). Zij stelt jaarlijks een fysieke en financiële handelsbalans voor Nederland op.
In elke chemische reactor geldt de wet van behoud van massa. Sterker, elke individuele chemische reactie is te beschouwen als een systeem: breng twee stoffen A en B bij elkaar en laat ze reageren tot C en D. De massa van A en B moet gelijk zijn aan de massa van C en D. Er kunnen balansen opgesteld worden voor herkenbare installaties of fabrieken, maar ook voor delen ervan. Er kan een balans worden opgesteld over een melkveehouderij, maar ook een balans over een klein stukje daarvan, de melktank. Om de CO2-uitstoot van een warmtekrachtcentrale te berekenen is het voldoende om de brander(s) in dat systeem te beschouwen, immers daar vindt de verbrandingsreactie plaats.
De massabalans kan bijvoorbeeld worden toegepast op fabrieken. Ook kan de massabalans gebruikt worden om de verblijftijd in een fabriek te berekenen.
Massabalans bij fabrieken
In de energiesector en de industrie bevinden zich veel fabrieken die continu produceren: er gaat voortdurend een aantal massastromen de fabriek in, terwijl er ook 24 uur per dag, 7 dagen in de week, producten en reststromen de fabriek verlaten. Een aantal voorbeelden daarvan met hun stromen zijn:• een pindakaasfabriek, waar continu pinda's, water, energie en (glas)verpakking wordt toegevoerd, en een continue stroom potten gevuld met pindakaas de fabriek verlaat.
• een elektriciteitscentrale gestookt op aardgas; de inputs zijn aardgas en lucht, de output (massa) is rookgas.
• een waterkrachtcentrale: zowel de (massa) input als de (massa) output is water.
• een afvalwaterzuiveringsinstallatie (awzi) die bijvoorbeeld het rioolwater van de regio Haaglanden verwerkt. De belangrijkste (massa)input is zuurstof (in lucht) voor de biologische afbraak, de outputs zijn CO2, effluent en zuiveringsslib.
Als er géén netto accumulatie of depletie in zo'n fabriek (in het continue systeem) optreedt, dan is deze te beschouwen als een open stationair systeem waarvoor de wet van behoud van massa en de balansvergelijking gelden. Voor de uitvoering van een systeemanalyse is deze vergelijking bijzonder handig. Door in de analyse van een fabriek te veronderstellen dat het gaat om een stationair systeem, is het mogelijk na inventarisatie van alle stromen ontbrekende of onbekende informatie af te leiden:
• Een pindakaasfabriek produceert dagelijks 100.000 potten pindakaas, met netto inhoud 700 g pindakaas. Bekend is dat de fabriek dagelijks slechts 60.000 kg pinda's verwerkt. De balansvergelijking vertelt hoeveel water, zout en suiker er bij de pindakaas wordt gemengd.
• Een moderne bierbrouwerij produceert 1 miljoen liter bier per dag. Het bedrijf gebruikt daarvoor dagelijks 6 miljoen liter water. Hieruit is direct duidelijk dat zo'n brouwerij dagelijks 5 miljoen liter afvalwater genereert.
• Een moderne 1000 MW aardgascentrales stookt zo'n 33,3 kg/s methaan (CH4) met 600 kg/s lucht. Uit de schoorsteen verdwijnt dan onvermijdelijk 633,3 kg/s rookgas(*).
• de awzi's in de regio Haaglanden hebben een zuiveringsrendement van 90%. Dat betekent dat het effluent het equivalent van 10% van de vuillast van de 1,5 miljoen inwoners in de Noordzee loost.
Uit deze voorbeelden blijkt dat het met een systeembenadering en kwantitatieve gegevens van een massabalans mogelijk is om relatief eenvoudig een idee te krijgen van de fysieke omvang van de stromen en daarmee de operatie van dergelijke fabrieken.
(*) Onderbouwing: het rendement van de modernste aardgascentrale in Nederland, de Máximacentrale in Flevoland, is 60%. Het thermisch vermogen van zo'n centrale is dus 1000 / 0,6 = 1667 MW. De stookwaarde (LHV) van methaan (aardgas) is ongeveer 50 MJ/kg; er is dus ca. 1667/50 = 33,3 kg/s methaan nodig. Een mol methaan wordt verbrand met 2 mol zuurstof. In lucht zit per mol zuurstof ongeveer 4 mol stikstof. Dat betekent dat voor elke 16 g methaan er 2 · 32 g zuurstof en 8 · 28 g stikstof wordt toegevoerd. Dat is dus (2 · 32 + 8 · 28) / 16 = 18 gram lucht per gram methaan. Dus bij 33,3 kg/s methaan hoort (stoichiometrisch) 33,3 · 18 = 600 kg/s lucht.
Verblijftijd
Een continu, stationair werkend systeem is in balans: de totale hoeveelheid massa die het systeem in gaat is gelijk aan de totale hoeveelheid massa die het systeem verlaat. Het gaat hierbij om de som van de massastromen Σφm, bijvoorbeeld 11,6 kg/s, wat gelijk staat aan 1000 ton/dag.
Voor een stationair systeem geldt dat de totale massastroom Σφm (kg/s of ton/dag) constant is. Tevens geldt dat de accumulatie ΔM gelijk is aan nul, ofwel de hoeveelheid massa M (kg) die in het systeem verblijft is constant.
Elk stationair systeem kan gekarakteriseerd worden met een verblijftijd θ (s). Er geldt:
$$ θ = {M_{\systeem}}/{Σφ_{\m,\in(i)}} = {M_{\systeem}}/{Σφ_{\m,\uit(j)}} $$
Is de totale massastroom 1000 ton/dag en de stationaire hoeveelheid massa in het systeem 1000 ton, dan is de verblijftijd θ gelijk aan één dag. Is de stationaire massa 11,6 kg, dan is de verblijftijd slechts één seconde.
Ook deze vergelijking kan weer omgekeerd gebruikt worden: als bekend is wat de doorstroom van een systeem en de verblijftijd zijn, dan is de massa of de stationaire voorraad in het systeem eenvoudig te berekenen.
De verblijftijd geeft een eerste indicatie hoe snel een systeem zal reageren op verstoringen. Als de verstoring te groot en te snel is dan kan het systeem te gronde gaan. Anderzijds kunnen systemen met een grote inhoud meestal wel tegen een stootje. Moderne productiesystemen bestaan uit zeer veel subsystemen en systeemelementen, die elk meestal een verschillende verblijftijd hebben. Als de spreiding in verblijftijden groot is, kunnen kleine verstoringen op de delen die een kleine verblijftijd hebben toch grote productie-eenheden ontregelen of zelfs lamleggen. Vaak is het onvermijdelijk dat verblijftijden verschillen of wordt er (bijvoorbeeld uit financiële overwegingen) voor gekozen.
In veel fabrieken worden de massastromen verwarmd met stoom, die veelal wordt geproduceerd in een warmtekrachtcentrale (WKC). Meestal wordt er voor gekozen om dit stoomsysteem een capaciteit te geven afgestemd op de continue verwarmingsbehoefte van de fabriek. Echter, als de fabriek heeft stilgestaan, is vaak veel warmte nodig om de gehele installatie en alle grondstoffen en tussenproducten op temperatuur te brengen. Andersom kan het voorkomen dat delen van een fabriek niet onder een bepaalde temperatuur mogen komen doordat dan bijvoorbeeld stolling van een reactiemengel optreedt. Vanwege de hoge kosten van een stoomsysteem met grotere capaciteit (grotere WKC, grotere leidingen etc.) kan dan bijvoorbeeld voor een slim gekozen en geplaatst (en relatief goedkope) bufferopslag in de fabriek gekozen worden.
Chemische reacties
Bij de analyse van energiesystemen moet rekening worden gehouden met optredende chemische reacties. Tijdens deze reacties reageren atomen en/of moleculen met zichzelf of met elkaar tot andere moleculen. N.B.: tijdens chemische reacties veranderen de atoomkernen niet! De isotopen van een element gedragen zich chemisch precies gelijk. Bijvoorbeeld:
H2 + 1/2 O2 → H2O
C2H4 + C2H4 → C4H8
Moleculen kunnen ook reageren tot (uiteenvallen in) hun samenstellende atomen. Bijvoorbeeld:
H2O → H2 + 1/2 O2
De samenstellende atomen blijven altijd de samenstellende atomen: in elke chemische reactie moet de elementenbalans voor elk element kloppen. Voor de algemene reactie:
nA + mB ⇔ pC + qD
moet dus voor alle soorten elementen gelden dat de som van het aantal atomen (respectievelijk C, O, H, N, S, Al, enz.) in stof A en B gelijk is aan de som van het aantal atomen (respertievelijk C, O, H, N, S, Al, enz.) in stof C en D.
Omdat atomen altijd in vaste verhoudingen aanwezig zijn in moleculen (wet van vaste verhoudingen) en omdat elk atoom een vast atoomgewicht heeft (uit te drukken in de atomaire massaeenheid u), zou aan chemische reacties gerekend kunnen worden in de eenheid u. Echter, omdat het in een chemisch laboratorium niet gemakkelijk is om een portie atomen of specifiek aantal moleculen af te meten, maar wél een hoeveelheid massa, zijn de begrippen mol en molmassa geïntroduceerd.
Reactiestoichiometrie
De verhouding waarin stoffen, moleculen, met elkaar reageren wordt de reactiestoichiometrie genoemd en wordt uitgedrukt als molverhouding.Voor de verbranding van zuiver methaan:
CH4 + 2 O2 → CO2 + 2 H2O
is de molverhouding CH4:O2 gelijk aan twee, terwijl de molverhouding CH4:CO2 gelijk aan één is. Er wordt in dit geval gezegd dat de reactiestoichiometrie CH4:O2 gelijk is aan 1:2.
Let op: doordat de molmassa van CH4 16 g/mol en van CO2 44 g/mol is, is de massaverhouding CH4:CO2 in deze reactie 16:44 = 1:44/16 = 2,75. Bij de verbranding van elke ton zuiver methaan (CH4) ontstaat dus 2,75 ton kooldioxide (CO2).
De reactiestoichiometrie, kortweg stoichiometrie, en het feit dat van elke soort atomen het aantal links en rechts van de pijl gelijk moet zijn, kan gebruikt worden om:
• te controleren of een gegeven reactievergelijking klopt en om
• voor een gegeven reactie een kloppende reactievergelijking op te stellen.
Anders gezegd: de boekhouding van een chemische reactie moet kloppen.
De reactievergelijking C8H18 + 8 O2 → 8 CO2 + 8 H2O klopt overduidelijk niet. Octaan heeft 8 koolstofatomen. Die reageren inderdaad tot 8 CO2, maar octaan heeft per molecuul ook 18 waterstofatomen, die reageren tot 9 H2O en daarvoor is 4,5 (mol) O2 nodig. De kloppende reactievergelijking is dus: C8H18 + 12,5 O2 → 8 CO2 + 9 H2O.
Verbrandingsreacties betreffen veelal koolwaterstoffen. Bestaan deze uit alleen koolstof en waterstof, dan kan de volgende algemene vergelijking worden opgesteld voor de verbrandingsreactie:
CxHy + (x + y/4) O2 → x CO2 + y/2 H2O
Het werken met reactievergelijkingen is handig in systeemanalyse, omdat het niet uitmaakt in wat voor soort systeem de reactie plaatsvindt. Weliswaar is de uitvoering van de verbrandingsreactie van suiker in een menselijk lichaam heel anders dan wanneer suiker verbrand wordt in een oven, maar de reactievergelijking is hetzelfde. De volledige afbraak van organisch afval (bijvoorbeeld lozing van melasse) in een meer vraagt precies evenveel zuurstof als verbranding van dit organisch afval.
Overmaat en ondermaat
De begrippen overmaat en ondermaat zijn gerelateerd aan de reactiestoichiometrie.• Als voor een reactiemengsel de reactanten in precies de juiste (mol)verhouding aanwezig zijn, dan is er sprake van overmaat noch ondermaat. Bijvoorbeeld als de molverhouding CH4 en O2 gelijk is aan 1:2 dan is er overmaat noch ondermaat voor de verbrandingsreactie van methaan. De volledige verbranding van een brandstof met precies genoeg zuurstof wordt een stoichiometrische verbranding of een verbranding met de stoichiometrische hoeveelheid zuurstof genoemd.
• Is de verhouding echter gelijk aan 1:4, dan wordt gesproken van een overmaat zuurstof. Er is dan meer zuurstof aanwezig in het reactiemengsel dan nodig om de methaan geheel te verbranden. Als de reactie is verlopen, zal het productmengsel onvermijdelijk nog zuurstof bevatten.
• In hetzelfde geval, molverhouding CH4:O2 gelijk aan 1:4, wordt gesproken van een ondermaat methaan. Er is onvoldoende methaan aanwezig in het reactiemengsel om alle zuurstof weg te laten reageren.
In de industrie wordt veel gebruik gemaakt van overmaat cq. ondermaat om zo het verloop en de evenwichtsligging van reacties gunstig te beïnvloeden. Hierop wordt ingegaan in het vak TB243E, Analyse van industriële systemen.
Molbalansen
Zoals eerder behandeld, reageert methaan met zuurstof (uit lucht) tot kooldioxide en water:CH4 + 2 O2 → CO2 + 2 H2O
Dit is een kloppende reactievergelijking doordat de elementenbalans of molbalans voor zowel koolstof, waterstof als zuurstof klopt: het aantal atomen koolstof, waterstof en zuurstof links van de pijl is steeds gelijk aan het aantal rechts van de pijl. Hun combinatie, de moleculen waarin ze voorkomen, is veranderd door de reactie.
Om uit te kunnen rekenen hoeveel kilogram CO2 er per kilogram CH4 ontstaat, is het nodig om zo'n kloppende reactievergelijking te hebben en dat gerekend wordt met de molmassa. In feite is het kloppend maken van een chemische reactievergelijking een probleem van lineaire algebra: een stelsel van lineaire vergelijkingen oplossen.
Voor verbrandingsreacties, reacties met koolwaterstoffen, is in het algemeen de vergelijking kloppend te maken door eerst te kijken naar de molbalans voor C (het aantal molen C links en rechts van de reactiepijl), vervolgens naar de molbalans van waterstof H en daarna zuurstof O.
Als bijvoorbeeld de belasting van een afvalwaterzuiveringsinstallatie (awzi) bekend is, m.a.w.: hoeveel organische stoffen er in een kubieke meter rioolwater zitten, hoeveel rioolwater de installatie verwerkt, dat het zuiveringsrendement bijvoorbeeld 90% is en wat de dagelijkse productie van zuiveringsslib is, dan kan met de kennis van afvalwaterzuivering een schatting gemaakt worden van de CO2-uitstoot. Er kan bijvoorbeeld aangenomen worden dat zuiveringsslib bestaat uit organisch materiaal (de netto groei aan biomassa van de micro-organismen die de organische vervuiling omzetten) en dat de rest van het organische materiaal door diezelfde micro-organismen wordt verbrand tot CO2 en water.
Mol en molmassa
Het begrip mol is gedefinieerd als het aantal atomen koolstof C in 12 gram 12C van dat materiaal, dus zuiver 12C. Dit is gelijk aan het getal van Avogadro :
NAvogadro = 6,022 · 1023 atomen/mol.
De molmassa van een atoom of molecuul is dan de massa van een mol atomen respectievelijk moleculen. NAvogadro koolstofatomen (zuiver 12C) hebben dus een molmassa van 12 g/mol.
Het begrip mol duidt dus een aantal aan en is daarmee te vergelijken met de begrippen 'dozijn' en 'gros'. Een dozijn computers is hetzelfde als 12 computers, een gros computers staat gelijk aan 144 computers en een mol computers betekent maar liefst een hoeveelheid van 6,022 · 1023 computers!
Elk element (C, Al, U etc.) heeft een unieke molmassa. De molmassa van zuurstofatomen is bijvoorbeeld 16 g/mol, dat van zuurstof O2 is daarmee 32 g/mol. Nota bene: voor (eerste orde) systeemanalyses wordt meestal de op 2 of 3 cijfers afgeronde molmassa gebruikt. Elke chemische stof (soort molecuul), zoals C2H6, C2H4 en H2O etc., heeft eveneens een unieke molmassa. De molmassa van een molecuul kan eenvoudigweg worden bepaald met behulp van de verhoudingsformule.
Een algemene formule voor de molmassa van koolwaterstoffen met verhoudingsformule CxHy is:
molmassaCxHy = x·molmassaC + y·molmassaH
Als van een stof niet precies bekend is uit welk molecuul of welke moleculen deze bestaat, kan vaak wél de verhoudingsformule bepaald worden. Uit deze verhoudingsformule kan dan een quasi-molmassa berekend worden, waaruit dan weer eigenschappen per massaeenheid (kilogram, ton) berekend kunnen worden. De verhoudingsformule van droge biomassa is bijvoorbeeld bij benadering CH2O. De quasi-molmassa is dus 30 g/mol.
Andersom vertegenwoordigt elke hoeveelheid massa van een stof ook een aantal molen. Bijvoorbeeld voor een kilogram aluminium (Al) geldt: 1 kg Al = 1000 g / 27 g/mol = 37 mol aluminium. Op dezelfde manier volgt uit de quasi-molmassa van biomassa dat een kilogram biomassa 33 (quasi-)molen bevat.
Het begrip mol is handig én noodzakelijk om te kunnen rekenen aan chemische reacties. Het impliceert dat niet alleen 2 atomen C met één molecuul O2 reageren tot 2 moleculen CO, maar ook dat 2 mol C met één mol O2 reageert tot 2 mol CO. Als de molmassa van elk afzonderlijk element bekend is, dan kan de massaverhouding van de benodigde reactanten en ontstane producten berekend worden. Deze informatie kan gehaald worden uit het Periodiek systeemw. Voor de vorming van koolmonoxide volgt dan eenvoudig dat 24 gram koolstof en 32 gram zuurstof reageren tot 56 gram koolmonoxide. Immers, volgens de reactievergelijking reageert 2 mol C met 1 mol O2 tot 2 mol CO, en de molmassa van koolstof (C) is gelijk aan 12 g/mol, dat van zuurstof (O2) is 32 g/mol, en koolmonoxide (CO) heeft een molmassa van 28 g/mol.
Het begrip mol stelt ook in staat de relatie te leggen tussen chemie en de inputs en outputs van industriële systemen, immers voor de laatste wordt zonder uitzondering met massa gerekend. De relatie tussen de inputs en outputs wordt echter vaak (mede)bepaald door de vaste verhoudingen waarin chemische reacties optreden.
Bij de voorbeelden van massabalansen bij fabrieken is het voorbeeld gegeven dat een moderne 1000 MW aardgascentrales zo'n 33,3 kg/s methaan met 600 kg/s lucht inneemt. De verbrandingsreactie van aardgas, methaan (CH4) suggereert dat methaan met zuurstof (uit lucht) reageert tot kooldioxide en water:
CH4 + 2 O2 → CO2 + H2O
De molmassa van methaan is ongeveer gelijk aan 1 · 12 + 4 · 1 = 16 g/mol. De molmassa van zuurstof is 2 · 16 = 32 g/mol. Als aardgas precies met de juiste hoeveelheid zuurstof wordt verbrand dan is volgens de vergelijking voor élke mol methaan 2 mol zuurstof nodig, dus voor elke 16 gram methaan is 2 · 32 = 64 gram zuurstof nodig. In een conventionele centrale wordt lucht gebruikt voor de verbranding. Naast zuurstof bevat lucht ook stikstof (lucht bevat bij benadering 21 vol.% zuurstof en 79 vol.% stikstof wat betekent dat, ervan uitgaande dat lucht zich gedraagt als een ideaal gas waardoor volumepercentage gelijk is aan molpercentage, lucht per mol zuurstof ook 79/21 mol stikstof bevat). Dat betekent dat voor elke 16 g CH4 er 2 · 32 g O2 en 79/21 · 2 · 28 g N2 wordt toegevoerd. Dat is dus: (2 · 32 + 79/21 · 2 · 28) / 16 = 17 g lucht per g methaan. Dus bij 33,3 kg/s CH4 hoort (stoichiometrisch) 33,3 · 17 = 566 kg/s lucht.
Atomen en moleculen
Voor het opstellen van balansen van processen waarin chemische reacties verlopen en voor het begrijpen van atoomkernreacties is het nodig iets te weten van de moderne basis van de chemie: atoomstructuur, moleculen en ionen. De moderne chemie gaat ervan uit dat materie is opgebouwd uit atomen, moleculen en ionen.
Voor het begrip van atomen en moleculen kan gekeken worden naar de volgende eenvoudige chemische reactie: de vorming van koolmonoxide (CO) uit koolstof (C) en zuurstof (O2). Koolstof (bijvoorbeeld in de vorm van grafiet) kan met zuurstof reageren tot koolmonoxide:
2C + O2 → 2 CO
Deze reactievergelijking introduceert een aantal fundamentele begrippen:
• atoom: atomen zijn de kleinste, chemisch ondeelbare bouwstenen van materie. Het zijn atomen koolstof en zuurstof die deelnemen aan de reactie tot koolmonoxide.
• molecuul: een molecuul is te definiëren als een geordende verzamelingen van atomen, bijeengehouden door (chemische) bindingen. Het molecuul zuurstof bestaat uit twee atomen zuurstof bijeengehouden door een (relatief sterke) chemische binding, waardoor zuurstof in de lucht relatief stabiel is en bestaat. Koolmonoxide bestaat uit een binding tussen koolstof en zuurstof.
• element: (chemische) elementen bestaan elk uit slechts één unieke soort atomen. Een zuivere hoeveelheid van elk element (bijvoorbeeld koolstof) bestaat slechts uit atomen van dat element (bijvoorbeeld koolstofatomen).
Ten slotte laat de reactievergelijking zien dat koolmonoxide, CO, bestaat uit koolstof C en zuurstof O in de vaste verhouding van 1:1. Zo'n vaste verhouding geldt niet alleen voor koolmonoxide, maar voor alle (zuivere) chemische verbindingen of moleculen.
Voor het opstellen van massa- en energiebalansen van systemen waarin chemische reacties plaatsvinden is het voldoende te weten dat elk molecuul niet anders is dan een geordende verzameling atomen, bijeengehouden door een chemische binding. Hoe en waarom die chemische binding werkt, en waarom sommige atomen binden met anderen, terwijl bijvoorbeeld edelgassen géén binding aangaan is het terrein van de (verklarende) chemie. Voor dit vak is het van belang te weten dat er moleculen bestaan, die elk opgebouwd zijn uit een vaste verzameling atomen.
Voorbeelden van moleculen
De eenvoudigste moleculen zijn H2, O2 en N2. Waterstof, zuurstof en stikstof bestaan elk uit twee gelijke atomen. Andere eenvoudige moleculen die zijn opgebouwd uit twee verschillende atomen zijn bijvoorbeeld koolmonoxide (CO), waterstoffluoride (HF) en waterstofchloride (HCl). De eenvoudigste moleculen opgebouwd uit drie atomen zijn water (H2O), kooldioxide (CO2) en zwavelwaterstof (H2S). Waterstofcyanide bestaat uit drie verschillende atomen: HCN.H2, O2, N2, CO, CO2, HF en HCl en ook HCN zijn voorbeelden van anorganische stoffen. Op grote schaal geproduceerde anorganische verbindingen zijn zwavelzuur (H2SO4) en ammoniak (NH3).
Zouten vormen een klasse van anorganische verbindingen. Zouten zijn opgebouwd uit ionen: deeltjes met een positieve of negatieve elektrische lading. Een ion kan bestaan uit een enkel atoom of uit meerdere atomen. De eenvoudigste zouten bestaan uit twee verschillende elementen, meestal een metaalion en een halogeenion. Het bekendste voorbeeld is keukenzout, NaCl, dat is opgebouwd uit Na+- en Cl--ionen.
Ionen spelen een belangrijke rol in elektrochemische reacties en -processen. Deze zijn belangrijk voor de ontwikkeling van nieuwe technieken voor energieconversie: fotovoltaïsche cellen (zon-PV), brandstofcellen) en voor de opslag van energie (batterijen voor mobiele telefoons, laptops, elektrische auto's). Op dit terrein vindt wereldwijd veel onderzoek en ontwikkeling plaats.
De atomen van een metaal zoals ijzer, Fe, worden bijeengehouden door de aantrekkingskrachten in het metaalrooster. Omdat elektronen daarin in zekere mate vrij kunnen bewegen, geleiden metalen elektrische stroom.
Naast de hiervoor genoemde anorganische verbindingen bestaan er ook organische verbindingen. Organische verbindingen zijn opgebouwd uit ten minste koolstof (C) en waterstof (H). De eenvoudigste koolwaterstof is methaan (CH4). Fossiele grondstoffen zijn zonder uitzondering mengsels van koolwaterstoffen.
Energievormen
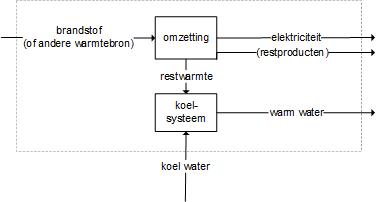
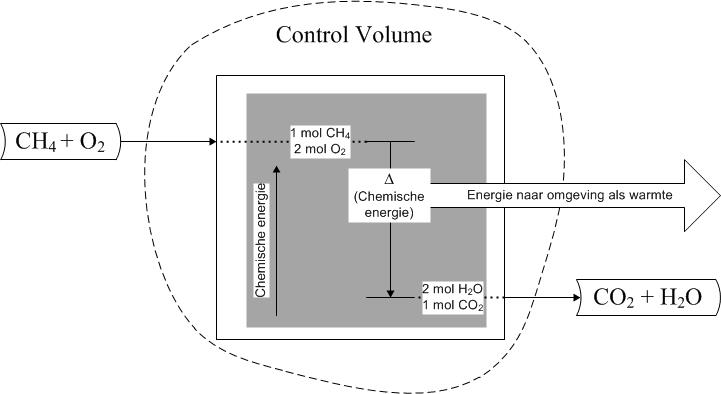
Wat is energie en welke energievormen zijn er? Volgens de wet van behoud van energie kan energie niet verloren gaan en ook niet uit het niets ontstaan, maar kan energie wel van vorm veranderen. In onderstaande figuur is te zien hoe de in methaan (CH4) aanwezige chemische energie wordt omgezet in warmte.
• chemische energie is de energie die een stof heeft als gevolg van de chemische bindingen in deze stof; een stof bestaat immers uit moleculen en deze moleculen bestaan weer uit atomen die door chemische bindingen bij elkaar worden gehouden.
Bij gesloten systemen, dus waarbij er geen massastromen de systeemgrens passeren, kan energie op twee manieren worden uitgewisseld tussen het systeem en de omgeving, of met een ander systeem, namelijk in de vorm van arbeid (W) of in de vorm van warmte (Q):
• arbeid (W) is gedefinieerd als een kracht F die werkt over een bepaalde afstand: δW = F · δl. De eenheid van arbeid is dus: [N] · [m] = [Nm] = [J]
• warmte is gedefinieerd als de vorm van energie die overgedragen wordt tussen twee systemen (of tussen een systeem en zijn omgeving) als gevolg van een temperatuurverschil.
Behalve arbeid en warmte zijn er nog andere vormen van energie, zoals:
• potentiële energie: de energie die een voorwerp heeft als gevolg van zijn positie (hoogte) ten opzichte van de aarde
• kinetische energie: de energie die een voorwerp heeft als gevolg van zijn beweging ten opzichte van de aarde
Een stilstaande kogel op 2 km hoogte heeft een hoeveelheid potentiële energie Epot = m·g·h, waarin m de massa, g de zwaartekrachtsversnelling en h de hoogte is. Als de kogel naar beneden valt verliest deze potentiële energie maar wint deze snelheid, en daarmee kinetische energie: Ekin = 1/2 m·v2, waarin v de snelheid is.
Bij energiesysteemanalyses wordt voor energie de eenheid joule (J) gebruikt. Een (verouderde) eenheid voor energie is de calorie [cal]. De calorie is gedefinieerd als de hoeveelheid warmte nodig om 1 gram water 1 °C in temperatuur te laten stijgen. Deze hoeveelheid warmte, 1 cal, is gelijk aan 4,184 J.
Gerelateerd aan energie is het begrip 'vermogen', de hoeveelheid energie per tijdseenheid, met als eenheid J/s of W (1 J/s = 1 (W)att).
Wet van behoud van energie
Analoog aan de 'wet van behoud van massa zegt de wet van behoud van energie'' dat, behoudens atoomkernreacties, de totale hoeveelheid energie van systeem plus zijn omgeving constant is. Een andere formulering van deze twee wetten is dat zowel massa als energie niet kunnen worden gecreëerd noch vernietigd.
Waar de wet van behoud van massa de basis is voor een boekhouding van materialen, is de wet van behoud van energie dat voor energie: deze boekhouding dient altijd sluitend te zijn.
Enkele voorbeelden:
• behoud van massa: als bekend is dat een afvalverbrandingsinstallatie per ton afval 100 kilogram aan bodemassen produceert, dan verdwijnt de overige 900 kilogram samen met de toegevoerde verbrandingslucht door de schoorsteen van de installatie (verondersteld dat de installatie continu werkt).
• behoud van massa: als de Rotterdamse haven jaarlijks 200 miljoen containers verwerkt en de totale hoeveelheid containers aanwezig in de Rotterdamse haven niet verandert, dan worden er zowel 200 miljoen containers aangevoerd, alsook 200 miljoen containers afgevoerd.
• behoud van energie: als een elektriciteitscentrale continu een kolenstroom verwerkt van 2000 MW en 1000 MW elektriciteit generereert, dan gaat er 1000 MW verloren naar het koelwater en het rookgas dat de centrale verlaat.
• behoud van energie: als een kantoorgebouw bij zonnig zomers weer 1000 kW aan zonnestraling ontvangt via de ramen, dan dient de airconditioning in dat gebouw minstens 1000 kW warmte af te kunnen voeren om te voorkomen dat de temperatuur in het gebouw stijgt.
Net als bij het werken met massabalansen is bij het werken met energiebalansen een systeembenadering op te zetten waarin onderscheid wordt gemaakt tot systeem en omgeving en waarbij vier typen open/gesloten systemen onderscheiden kunnen worden.
De wet van behoud van energie vormt de basis voor het opstellen van een energiebalans over een systeem. Voor elk systeem zal altijd gelden:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = \accumulatie $$
Wanneer er sprake is van het omzetten van de ene energievorm in de andere, energieconversie, moet er goed worden opgelet dat alle in- en uitgaande energiestromen worden meegenomen bij het opstellen van de energiebalans.
Energieconversie
In module TB141E, Introductie in Energie- & Industriesystemen, is aan de hand van de Nederlandse energiebalans al kort ingegaan op het verbruik van energiedragers in de verschillende sectoren.
Enkele voorbeelden van energieconversiesystemen zijn:
• in een fornuis wordt brandstof gecontroleerd verbrand met lucht, zodat de vrijkomende warmte kan worden benut om eten te koken, maar ook om bijvoorbeeld water om te zetten in stoom, of om een reactiemengsel te verwarmen.
• een centrale verwarmingsinstallatie (kortweg CV-installatie of CV) zorgt voor ruimteverwarming. In ons land is ruimteverwarming een deel van het jaar nodig doordat geen enkele (woon)ruimte perfect geïsoleerd is en na verloop van tijd door warmteverliezen dezelfde temperatuur zou aannemen als haar omgeving. 90% van de Nederlandse huishoudens heeft een centrale verwarmingsinstallatie gestookt op aardgas. De chemische energie van het methaan wordt omgezet in warmte die via de radiatoren wordt afgegeven aan de woonruimtes.
• een auto heeft kracht, vermogen, nodig om te versnellen en om in beweging te blijven. Ontbreekt aandrijfvermogen dan komt de auto onvermijdelijk tot stilstand door wrijving (lucht, wielen). De meeste auto's zijn uitgerust met een verbrandingsmotor die de brandstof (benzine, diesel, LPG) gebruikt om een as te laten draaien die de wielen aandrijft. Elektrische auto's gebruiken elektriciteit opgeslagen in een batterij voor de elektromotoren die de aandrijving verzorgen.
• in een batterij vindt een elektrochemische reactie plaats waardoor een potentiaalverschil tussen de twee elektrische polen ontstaat. Als deze, via een (elektrische) weerstand (de gebruiker van elektriciteit) worden verbonden, dan zal een stroom gaan lopen, en wordt het verbonden apparaat (de gebruiker) van elektriciteit voorzien.
• in moderne elektriciteitscentrales worden hoge-druk stoomturbines (steenkool, nucleair) toegepast, in aardgascentrales zijn het gasturbines, en in waterkrachtcentrales zijn hydroturbines in gebruik om kracht (beweging) door middel van een generator om te zetten in elektriciteit.
Typen energieconversie
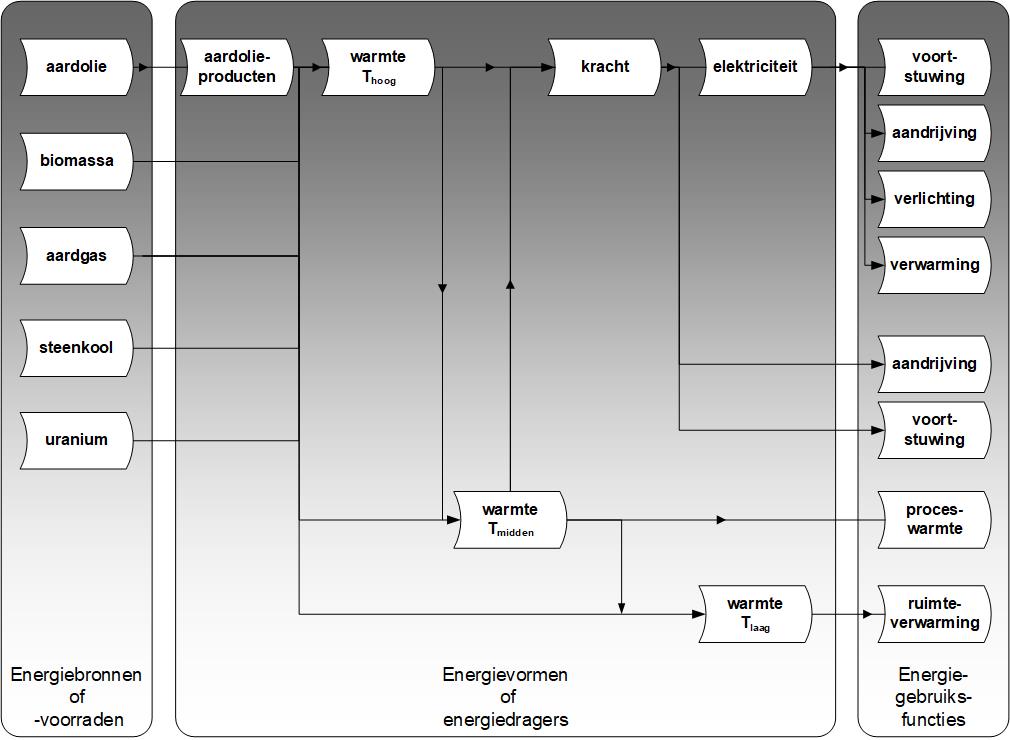
In bovengenoemde systemen treedt per saldo slechts een beperkt aantal typen energieomzettingen op, zie ook onderstaande figuur.
Een aantal van deze energieomzettingen vindt spontaan (in de natuur) plaats, bijvoorbeeld de overdracht van warmte Q van een reservoir met hoge temperatuur naar een reservoir met lage temperatuur. Ook de omzetting van elektriciteit in warmte (bij het geleiden van stroom door een weerstand) gaat vanzelf, net als het omzetten van arbeid in wrijvingsverlies. Door deze omzettingen gecontroleerd te laten plaatsvinden kan daadwerkelijk nuttig gebruik worden gemaakt van het product van de omzetting en daarmee van de kostbare energiedrager.
De omgekeerde omzettingen, warmte van lage naar hoge temperatuur of van warmte naar kracht, gaan nooit spontaan. Daar zijn altijd technische installaties voor nodig, respectievelijk een warmtepomp en een thermische (elektriciteits)centrale.
De volgende typen energieconversie zijn in de figuur te onderscheiden:
• omzetting van chemische of verbrandingsenergie (LHV) in warmte van hoge temperatuur (Th = 800-2000 °C) door verbranding, bijvoorbeeld in fornuis. Voorbeelden zijn:
- verbranding van aardgas in een CV-installatie, gasturbine of industrieel fornuis
- stoken van het fornuis van grote elektriciteitscentrales met poederkool en/of biomassa
- gebruik van hoogoven gas (een mengsel van CO en H2) als brandstof in een warmtekrachtcentrale
- gebruik van benzine, diesel en LPG in verbrandingsmotoren
- stoken van de barbecue met houtskool
• splijting van uranium tijdens een kernreactie voor de productie van warmte
• conversie van een warmtestroom Q naar een warmtestroom met lagere temperatuur, d.m.v. een warmtewisselaar:
- van hoge temperatuur Th (800-2000 °C) naar middentemperatuur Tm (200-800 °C). Een voorbeeld is de overdracht van verbrandingswarmte uit rookgas naar (hoge-druk) stoom in een elektriciteitscentrale.
- van middentemperatuur Tm (200-800 °C) naar lage temperatuur Tl (60-200 °C). Belangrijkste voorbeeld is de overdracht van de warmte van de verbrandingskamer in een CV-ketel naar het water dat verwarmd wordt.
- van lage temperatuur Tl (60-200 °C) naar omgevingstemperatuur T0 (5-25 °C). Dit is meestal de laatste stap in ruimteverwarming. Ook in elektriciteitscentrales vindt deze transformatie plaats bij het afgeven van restwarmte aan koelwater.
• conversie van een warmtestroom Q (Th) naar arbeid W (via stoom- en/of gascyclus). Dit is de belangrijkste energieconversie: het omzetten van warmte naar arbeid (elektriciteit) stelt ons in staat productie en transport te mechaniseren. Tegenwoordig zijn er twee hoofdtypen energieconversiesystemen waarin deze conversie wordt gerealiseerd:
- zonder co-productie van een nuttig te gebruiken warmtestroom. Naast de omzetting van warmte Q (Th) naar arbeid W ontstaat (onvermijdelijk) een warmtestroom op omgevingstemperatuur Qrest(T0). Anders gezegd: een grootschalige elektriciteitscentrale produceert slechts elektriciteit als nuttig product.
- mét co-productie van een warmtestroom die nuttig wordt toegepast, bijvoorbeeld in een fabriek, tuinbouwkas of stadsverwarmingsnet. Naast arbeid produceert een warmtekrachtcentrale dan een warmtestroom Qproduct (Tm en/of Tl).
• arbeid W opgewekt uit Q (Th) kan vervolgens gebruikt kan worden om:
- een generator aan te drijven, dit is een grote dynamo voor het opwekken van elektrische (wissel)stroom
- rechtstreeks aandrijving en voortstuwing te verzorgen (aandrijfas van machines, auto's etc); veelal wordt hierbij een tandwielkast of versnellingsbak toegepast om het aantal omwentelingen te regelen
• elektriciteit kan vervolgens worden gebruikt om een scala aan machines en/of apparaten aan te drijven en voor verlichting en elektrische verwarming.
Een voorbeeld van een energiesysteem waarin de hiervoor beschreven energieomzettingen te vinden zijn is een centrale verwarmingsinstallatie.
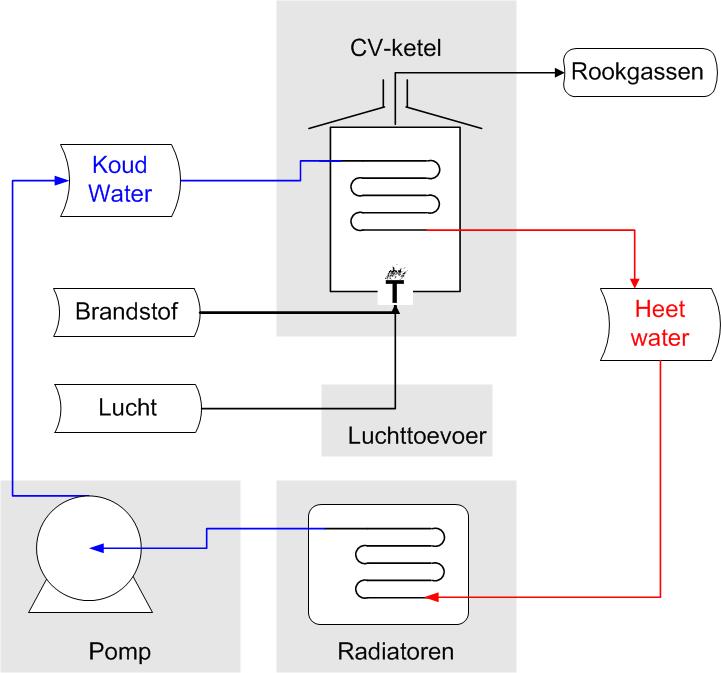
Centrale verwarmingsinstallatie
Een centrale verwarmingsinstallatie (CV-installatie of kortweg CV) kan schematisch weergegeven worden zoals in onderstaande figuur.
In een CV-installatie wordt brandstof, in Nederland meestal aardgas, met lucht verbrand. De chemische energie in de brandstof komt vrij als warmte (de vuurhaardtemperatuur is ± 1100 °C) waardoor de ontstane rookgassen een hoge temperatuur Th krijgen. De warmte in het rookgas wordt via een warmtewisselaar(*) overgedragen aan koud water dat afkomstig is van de radiatoren. Na passage van de warmtewisselaar voert het nu opgewarmde radiatorwater met temperatuur Tl de overgedragen warmte naar de radiatoren in de huiskamer. Daar vindt tenslotte de omzetting van lage-temperatuur warmte naar huiskamerwarmte plaats: Q (Tl) → Q (T0).
De installatie werkt met een elektrisch aangedreven pomp die het afgekoelde radiatorwater weer terugpompt naar de ketel. Hier wordt dus elektriciteit omgezet in arbeid die gebruikt wordt om de kinetische en potentiële energie van het water te verhogen. Deze gaat verloren door wrijving in het systeem, waarbij wederom warmte ontstaat. De laatste energieomzetting is die van restwarmte van midden- of lage temperatuur in het rookgas naar omgevingstemperatuur.
De energieconversie van lage temperatuur Tl naar omgevingstemperatuur T0 = 10-25 °C verloopt in veel gevallen spontaan - denk bijvoorbeeld aan de afkoeling van een kamer als de verwarming uitgezet wordt - maar vaak ook actief door het gebruik van koeling (met lucht of water). Bijvoorbeeld door te ventileren of te koelen om de warmte af te voeren die afgegeven wordt door elektrische apparatuur die in een afgesloten ruimte staat te draaien.
In Nederland is meer dan 90% van de huishoudens uitgerust met een CV-installatie met eigen ketel. Slechts een beperkt aantal huishoudens gebruikt nog kachels of is aangesloten op een stadsverwarmingsnet. Bij 90% van de huishoudens valt dus de verwarming uit als de elektriciteit uitvalt doordat de werking van zelfs een eenvoudige CV-ketel afhankelijk is van de werking van de circulatiepomp. Moderne, geavanceerde CV-ketels gebruiken daarnaast elektriciteit voor de ingebouwde elektronica voor besturing en beveiliging.
In het Verenigd Koninkrijk worden veel woningen verwarmd met elektriciteit. Tot 1950-1960 gebruikte men steenkool (kachels), maar vanwege smogproblemen hebben veel huishoudens gekozen voor elektrische verwarming: stroom (opgewekt uit steenkool) was lange tijd goedkoop en overal beschikbaar. Stadsgas of aardgas was en is lang niet overal beschikbaar in het Verenigd Koninkrijk.
(*) In het vak TB241E, Fysische transportverschijnselen, wordt ingegaan op de werking van warmtewisselaars.
Omzetting van warmte in elektriciteit
Het is onmogelijk om warmte voor 100% in arbeid (elektriciteit) om te zetten. Dit is een formulering van de 2e hoofdwet van de thermodynamica en hier wordt in het vak TB242E, Processen in de energiesector, uitgebreid bij stilgestaan.
Volgens deze 2e hoofdwet van de thermodynamica:
• stroomt energie in de vorm van warmte spontaan van een hoog temperatuurniveau naar een laag temperatuurniveau, maar NIET andersom. Ook al is de hoeveelheid lauwwarm water nog zo groot, er is geen apparaat denkbaar om daar spontaan een heet bad van te maken. Een gekoeld kratje bier neemt vanzelf weer de temperatuur van de kamer aan. Om het bier weer te koelen, zal het een tijdje in de koelkast moeten staan en die trekt stroom uit het stopcontact.
• kan energie in de vorm van arbeid wél volledig worden omgezet in warmte, maar kan warmte NIET volledig worden omgezet in arbeid. Voor tijdelijke bijverwarming in een studentenkamer is het gemakkelijk om een elektrisch straalkacheltje te installeren. De 1,5 kiloWatt die zo'n kacheltje uit het stopcontact trekt maakt de ruimte snel behaaglijk warm, maar mocht dat al gewenst zijn dan zou de warmte in die kamer maar voor een zeer klein deel weer terug om te zetten zijn in elektriciteit (arbeid).
Het maximale, theoretische, rendement waarmee warmte omgezet kan worden in arbeid wordt gegeven door het Carnot-rendement.
Carnot-rendement
Het Carnot-rendement is gedefinieerd als:$$ \η_{\C} = 1 - {T_{laag}}/{T_{\hoog}} $$
met:
$T_{\hoog}$ = temperatuur van de warmte die gebruikt wordt om arbeid uit te produceren [K]
$T_{\laag}$ = temperatuur van de (rest)warmte die als gevolg van de 2e hoofdwet afgevoerd moet worden [K]
Rendement van grootschalige elektriciteitscentrales
Aangezien het bij thermische centrales bij uitstek gaat om de omzetting van warmte in arbeid (elektriciteit) is het Carnot-rendement op deze installaties van toepassing. Voor het bepalen van het maximale, theoretische, rendement van een thermische centrale wordt in de formule voor het Carnot-rendement bij Thoog de hoogste temperatuur in de thermische centrale ingevuld (de temperatuur in de vuurhaard, dus daar waar de brandstof wordt verbrand) en bij Tlaag de laagste temperatuur (die van het koelmedium, meestal koelwater).Uit de formule voor het Carnot-rendement volgt dat:
• het maximale, theoretisch haalbare, rendement van de omzetting van warmte in arbeid toeneemt als Thoog hoger wordt:
- dit betekent dat de temperatuur in de verbrandingsoven ter plaatse van de stoompijpen van de centrale hoger moet liggen, maar:
- deze temperatuur wordt op haar beurt begrensd door de maximaal met de brandstof te bereiken (adiabatische) vlamtemperatuur en door de inrichting van het fornuis en
- verlaging van de oventemperatuur kan nodig zijn vanwege veiligheidseisen en de eigenschappen van de in de oven cq. de stoompijpen gebruikte materialen. Denk hierbij aan de sterkte bij hoge druk en temperatuur en aan de inwerking van corrosieve verbindingen in het rookgas.
• het maximale, theoretisch haalbare, rendement van de omzetting van warmte in arbeid toeneemt als Tlaag lager wordt:
- dit betekent dat er voor een maximaal rendement van een elektriciteitscentrale gezocht wordt naar een zo laag mogelijke koelwatertemperatuur.
- deze temperatuur bepaalt tegen welke temperatuur de afgewerkte stoom uit de stoomturbine kan worden gecondenseerd.
- deze temperatuur varieert meestal door het jaar heen. In het binnenland kan de oppervlaktewatertemperatuur van rivieren 's zomers flink stijgen. De fluctuatie van de zeewatertemperatuur is meestal kleiner. Is een koeltoren geïnstalleerd dan vertaalt een hogere buitenluchttemperatuur zich direct in een verlaagd rendement van de centrale.
Het praktisch gerealiseerde rendement van een thermische centrale ligt (uiteraard) lager dan het maximale, theoretisch haalbare, Carnot-rendement en wordt bepaald door:
• het werkelijke rendement van alle apparaten in de centrale (stoomketel, warmtewisselaars, leidingen, stoomturbine, pompen, ...) en
• het interne elektriciteitsverbruik van apparatuur in de centrale nodig voor continue bedrijfsvoering (molens voor het vermalen van steenkool, koelwaterpompen, ventilatoren en circulatiepompen in de rookgasreiniging zijn hierbij de grootste verbruikers).
Voor het berekenen van de benodigde hoeveelheid koelwater om de restwarmte weg te koelen is niet alleen de temperatuur maar ook de warmtecapaciteit van het koelwater van belang.
Warmtecapaciteit
Voor het berekenen van de benodigde hoeveelheid koelwater is de warmtecapaciteit van het koelmedium belangrijk. De warmtecapaciteit is de hoeveelheid warmte die opgenomen wordt per graad temperatuurstijging (of eigenlijk: de hoeveelheid warmte die benodigd is per graad temperatuurstijging), zie hiervoor ook de definitie van de calorie.
Elke stof heeft een eigen warmtecapaciteit. De specifieke warmtecapaciteit, dat wil zeggen de warmtecapaciteit per hoeveelheid massa, wordt uitgedrukt in de eenheid kJ/kgK (of J/gK). De warmtecapaciteit van een vloeistof is licht afhankelijk van de temperatuur van die vloeistof. Voor water bij 1 bar en temperaturen tussen 20 en 60 °C bedraagt de specifieke warmtecapaciteit ca. 4,18 kJ/kgK. Voor globale energiesysteemanalyses kan de warmtecapaciteit constant worden verondersteld, maar bij gedetailleerde ontwerpberekeningen moet de temperatuursafhankelijkheid uiteraard meegenomen worden. Een andere benaming voor de specifieke warmtecapaciteit is de soortelijke warmte.
Uit de definitie en eenheid van de specifieke warmtecapaciteit volgt als vanzelf (controle eenheden!) dat geldt:
$$ Q = φ_{\m} · c_p · \ΔT $$
met:
$Q$ = hoeveelheid warmte [kJ/s]
$φ_{\m}$ = massastroom [kg/s]
$c_\p$ = specifieke warmtecapaciteit bij opwarming bij constante druk [kJ/kgK]
$\ΔT$ = temperatuurverschil [K] (of °C want het gaat hier om het verschil en er geldt 273,15 K = 0 °C)
Toepassingsvoorbeelden
Met behulp van deze eenvoudige vergelijking kan berekend worden tot welke temperaturen warmtestromen of warmtelozingen leiden. Zo zou bijvoorbeeld geschat kunnen worden hoeveel de temperatuur van het IJsselmeer toeneemt ten gevolge van de stroomproductie in de Máximacentralew. Deze heeft een elektrisch vermogen van zo'n 1000 MW. Doordat het rendement ongeveer 60% bedraagt, gaat 40/60 · 1000 = 667 MW aan warmte met het opgewarmde koelwater het IJsselmeer in. Als bekend is hoeveel water door het IJsselmeer stroomt (van de IJssel via de sluizen in de Afsluitdijk naar de Waddenzee) kan een schatting worden gemaakt van de maximale temperatuurstijging door aan te nemen dat er sprake is van ideale menging en dat er geen warmte naar de lucht verdwijnt maar dat alle restwarmte van de Máximacentrale terecht komt in het IJsselmeer.
Wat dichter bij huis kan deze formule gebruikt worden om uit te rekenen hoeveel elektriciteit er nodig is om een bad van 200 liter water te vullen met water van 40 °C uit een elektrische boiler.
Uit de formule blijkt ook dat bij het opslaan van warmte de grootte van zo'n opslagsysteem beperkt kan worden door een stof met hoge warmtecapaciteit te kiezen dan wel een groot temperatuurverschil te gebruiken. Vanwege de veiligheid wordt voor warmteopslagsystemen echter meestal water gebruikt. In Nederland wordt bijvoorbeeld steeds meer warmte/koude opslag gebruikt: 's zomers wordt warmte opgevangen in een tuinbouwkas of gebouw gebruikt om opgepompt diep grondwater op te warmen, dat vervolgens weer teruggevoerd wordt, bijvoorbeeld zo'n 300 m onder de grond. In de winter vindt het omgekeerde proces plaats. Glastuinders hebben vaak een bovengrondse warmteopslag geïntegreerd met hun warmtekrachtcentrale waarin ze warm water van zo'n 80-90 °C opslaan. Deze voorraad is meestal voldoende om de kas twee à drie dagen van warmte te voorzien.
Voor energiesysteemanalyses aan continue systemen kan meestal een voldoende nauwkeurige berekening uitgevoerd worden door aan te nemen dat het warmteverlies naar de omgeving van de installatie te verwaarlozen is.
Koeling van thermische centrales
Het aandeel restwarmte dat ontstaat bij de verbranding van steenkool is GROTER dan het aandeel elektriciteit: een typische steenkoolcentrale die 1000 MW elektrisch vermogen levert, genereert ook zo'n 1100 MW aan restwarmte, continu! Deze hoeveelheid is evenveel als de warmtebehoefte van 100.000 huishoudens op een winterse dag.
De keuze voor de methode van koeling is dan ook erg belangrijk: om te verzekeren dat de centrale altijd kan en mag blijven werken, en voor de beheersing van de kosten. De restwarmtestroom vormt een zeer belangrijke fysieke relatie met de directe omgeving van de centrale. Er zijn ruwweg twee mogelijkheden om de restwarmte te lozen in de omgeving: naar een oppervlaktewatersysteem of naar de lucht. Daarnaast is het ook mogelijk om restwarmte nuttig te gebruiken.
Directe koeling met een oppervlaktewatersysteem
Voor het wegkoelen van de restwarmte kan een warmtewisselaar worden gebruikt waar aan de warme kant de afgewerkte stoom uit de stoomturbine wordt geleid en aan de koude kant koelwater of koellucht. Omdat een grote centrale van 1000 MW wel 1100 MW restwarmte produceert, is directe koeling met lucht meestal geen optie - er zou een zéér grote installatie moeten worden gebouwd, tegen zeer hoge kosten. Water kan per m3 veel meer warmte opnemen dan lucht. Grote centrales worden dan ook vaak aan zee of aan grote rivieren gebouwd. Aan deze watersystemen kunnen zij dan stroomopwaarts het benodigde koelwater onttrekken en stroomafwaarts van de centrale kan het opgewarmde koelwater geloosd worden op de rivier. Wordt zeewater gebruikt op een kustlocatie, dan dienen in- en uitlaatpunten zo te worden gekozen dat geen circulatie van geloosd koelwater naar de inlaat optreedt, want dat zou nadelige effecten voor het rendement van de centrale hebben.Bij kerncentrales is niet alleen koeling van de afgewerkte stoom nodig, maar ook van de reactorkern; als deze koeling wegvalt én de zogenaamde moderatoren falen dan is er in oudere typen kerncentrales gevaar van oververhitting van de kern. Dat is één van de redenen waarom kerncentrales vaak aan zee worden gebouwd: daar is in principe altijd voldoende koelwater.
Indirecte koeling met een koeltoren
Het is ook mogelijk grote centrales te bouwen op locaties waar geen grote hoeveelheden oppervlaktewater beschikbaar zijn. De centrale wordt dan uitgebreid met één of meer koeltorens waarin water verdampt wordt. Het gaat hier dan om indirecte koeling: in plaats van inname van koelwater en lozing naar rivier of zee wordt koelwater nu continu gerecirculeerd via de koeltoren. In de koeltoren wordt het opgewarmde koelwater in temperatuur verlaagd door water te sproeien en dat met de restwarmte uit de centrale te laten verdampen. Het verdampen van het water kost warmte en aangezien deze warmte afkomstig is van het koelwater neemt de temperatuur van het koelwater daardoor af. Er kan met een relatief kleine hoeveelheid te verdampen water worden volstaan doordat de benodigde hoeveelheid warmte om water te verdampen vele malen groter is dan de warmtecapaciteit van water.Omdat koeltorens werken met natuurlijke convectie, net als bij een schoorsteen stroomt de lucht door natuurlijke trek van onder naar boven, en vanwege de grote hoeveelheden weg te koelen warmte zijn koeltorens enorme installaties van typisch zo'n 70 m diameter en 130 m hoogte.
Nadelen van een hogere koelwatertemperatuur
Als een thermische centrale in bedrijf is, zal naar gelang het jaargetijde de werkelijke koelwaterinlaattemperatuur afwijken van de ontwerptemperatuur; met name in hete zomers zal de temperatuur hoger zijn. Er treden dan twee effecten op die het rendement van de thermische centrale negatief beïnvloeden:• het maximaal te behalen rendement neemt af
• de benodigde hoeveelheid koelwater is groter waardoor er meer energie nodig is om de koelwaterpompen te laten draaien. Bij gelijkblijvende hoeveelheid restwarmte en een kleiner temperatuurverschil tussen het ingenomen en geloosde koelwater zal er immers een grotere hoeveelheid koelwater nodig zijn. Zelfs als ook de temperatuur van het geloosde koelwater toe kan (mag!) nemen, wordt het temperatuurverschil tussen de af te koelen stroom en het koelwater kleiner waardoor de warmteoverdracht slechter verloopt en er ook meer koelwater nodig is.
Toestandsgrootheden
Toestandsgrootheden zijn macroscopische kenmerken van stoffen of systemen die niet afhangen van de weg die gevolgd is om tot de toestand van deze stof of dit systeem te komen, m.a.w.: toestandsgrootheden zijn padonafhankelijk. Voorbeelden van toestandsgrootheden zijn druk, temperatuur en specifiek volume. Het specifieke volume is het volume van een stof per hoeveelheid van die stof.
Een toestandsgrootheid die van belang is bij de analyse van thermische centrales is enthalpie (H). Voor nu is het voldoende om te weten dat met enthalpie de hoeveelheid energie van een stof wordt aangeduid. In het vak TB242E, Processen in de energiesector, wordt dieper ingegaan op de grootheid enthalpie en andere toestandsgrootheden.
De enthalpiewaarde van een fossiele brandstof is hoger dan die van de verbrandingsproducten kooldioxide en water. Dit betekent dat de verbranding van fossiele brandstoffen zorgt voor een afname van de hoeveelheid enthalpie. Deze enthalpieafname is gelijk aan de hoeveelheid warmte die vrijkomt bij de verbrandingsreactie. De enthalpieverandering die optreedt door een reactie wordt de reactie-enthalpie genoemd.
Er kan gekozen worden wat er met de vrijgekomen warmte gedaan wordt: er kunnen immers verschillende technologieën toegepast worden. Bijvoorbeeld, bij de verbranding van een ton steenkool in de open lucht verspreiden de hete rookgassen zich, wordt de vrijgekomen warmte geheel opgenomen door de omgeving en wordt er dus geen arbeid geproduceerd. Echter, wordt de steenkool verbrand in een elektriciteitscentrale, dan wordt ongeveer 45% van de vrijgekomen warmte omgezet in arbeid (de elektriciteit die wordt geproduceerd) en wordt de overige 55% via koelwater, rookgassen en stralingsverlies als warmte afgegeven aan de omgeving. In beide gevallen geldt de wet van behoud van energie.
De enthalpiewaarde van een stof, bijvoorbeeld aardgas, is een toestandsgrootheid en is dus niet afhankelijk van de manier waarop dit aardgas is gevormd, maar alleen van de samenstelling en condities (druk, temperatuur, ...) van dit aardgas.
Warmte en arbeid zijn ook energievormen, maar zijn géén toestandsgrootheden. De hoeveelheden warmte en arbeid zijn wél afhankelijk van de weg/route die afgelegd wordt en de technologie die toegepast wordt. Zie ook het voorbeeld hierboven over de verbranding van steenkool.
Reactie-enthalpie
Bij een reactie zijn de enthalpiewaarde van de grondstoffen, de reactanten, anders dan die van de producten. De totale hoeveelheid enthalpie in de reactanten kan hoger of lager zijn dan de totale hoeveelheid enthalpie in de producten. Het verschil tussen de hoeveelheid enthalpie in de reactanten voordat de reactie plaatsvindt en de hoeveelheid enthalpie in de producten (en misschien ook nog wat reactanten) na afloop van de reactie wordt de reactie-enthalpie genoemd. In formulevorm:
ΔrH = ΣHproducten - ΣHreactanten
Let op: een "Δ" betekent altijd "uit" min "in" oftewel: "producten" min "reactanten".
Als de ΔrH negatief is, is er sprake van een afname in enthalpie. Deze hoeveelheid enthalpie komt vrij als warmte en de reactie wordt dan exotherm genoemd. Wanneer er door het systeem geen arbeid wordt verbruikt of geproduceerd maar alleen warmte wordt uitgewisseld met de omgeving, geldt er:
$$ \Δ_{\r}H = Q $$
NB: Volgens bovenstaande vergelijking is Q een negatief getal bij een exotherme reactie. Bij het vak TB242E, Processen in de energiesector, wordt hier verder op ingegaan. Bij dit vak nemen we voor de vrijkomende warmte de absolute waarde van de reactie-enthalpie, ofwel:
$$ Q = |\Δ_{\r}H| $$
Verbrandingsreacties zijn exotherme reacties. Voor de verbranding van waterstof en methaan met zuivere zuurstof geldt bijvoorbeeld:
H2 + 1/2 O2 → H2O ΔrH = -119,9 MJ/kg H2
CH4 + 2 O2 → CO2 + 2 H2O ΔrH = -50 MJ/kg CH4
De reactie-enthalpie van een verbranding wordt ook wel verbrandingsenthalpie of verbrandingswarmte genoemd. De hoeveelheid energie die vrijkomt bij de verbranding van een brandstof kan worden uitgedrukt in LHV en HHV.
Wanneer een reactie-enthalpie onbekend is, kan deze door toepassing van de wet van Hess berekend worden uit de vormingsenthalpieën van de reactanten en producten.
LHV en HHV van brandstoffen
Een belangrijke eigenschap van brandstoffen is de hoeveelheid energie die vrijkomt bij de verbranding, de reactie-enthalpie van de verbranding.
Bij deze verbrandingsenergie wordt onderscheid gemaakt in de fase (gas of vloeistof) van de verbrandingsproducten en dan met name of het ontstane water aanwezig is in de gasfase (waterdamp) of in de vloeistoffase.
De LHV (Lower Heating Value), ook wel onderste verbrandingswaarde of stookwaarde genoemd, is de verbrandingsenergie wanneer het ontstane water zich in de gasfase bevindt.
De HHV (Higher Heating Value), ook wel bovenste verbrandingswaarde genoemd, is de verbrandingsenergie wanneer het ontstane water zich in de vloeistoffase bevindt. De HHV is hoger dan de LHV doordat bij de berekening van de HHV ook de warmte wordt meegenomen die vrijkomt wanneer water overgaat van de gas- naar de vloeistoffase (de condensatiewarmte).
De deelreacties voor het bepalen van de HHV van methaan zijn:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) (LHV van methaan)
2 H2O(g) → 2 H2O(l) (condensatiewarmte)
en de overall-reactie is:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) (HHV van methaan)
Wet van Hess
Aangezien enthalpie een toestandsgrootheid is, is de enthalpieverandering ΔH tussen toestand 1 en toestand 2 onafhankelijk van de weg die wordt bewandeld om van toestand 1 in toestand 2 te komen. Dit betekent ook dat een reactie kan worden opgeknipt in deelreacties en dat de som van de ΔrH's van de deelreacties gelijk is aan de ΔrH van de gehele reactie. Dit wordt de wet van Hess genoemd.
Bijvoorbeeld voor de enthalpieverandering van de verbranding van methaan geldt dat deze gelijk is aan 50 MJ/kg. Dit geldt zowel wanneer de weg wordt gevolgd van de reactie:
(1) CH4 + 2 O2 → CO2 + 2 H2O
als voor de weg via deelreacties waarbij methaan eerst wordt omgezet in koolmonoxide (CO) en waterstof H2 en waarna de koolmonoxide en waterstof alsnog verbranden tot CO2 en H2O:
(2) CH4 + 1/2 O2 → CO + 2 H2
(3a) CO + 1/2 O2 → CO2
(3b) 2 H2 + O2 → 2 H2O
Volgens de wet van Hess geldt:
ΔrH(1) = ΔrH(2) + ΔrH(3a) + ΔrH(3b)
De wet van Hess is bijzonder handig voor het rekenenen met reactie-enthalpieën. Volgens deze wet kan elke reactie immers worden opgesplitst in deelreacties en kunnen deelreacties worden gecombineerd tot totaalreacties. Op deze manier kunnen dus ontbrekende gegevens van reacties berekend worden. Hierbij zijn twee dingen van belang:
• als de richting van een reactie wordt omgekeerd, verandert het teken van de enthalpieverandering.
• de grootte van ΔrH is afhankelijk van de hoeveelheid reactanten en producten. In tabellenboeken wordt daarom altijd de reactie-enthalpie per mol gegeven en wordt aangegeven op welke reactant de reactie-enthalpie betrekking heeft (bijvoorbeeld per mol methaan).
Toepassingsvoorbeeld
Gevraagd wordt de enthalpieverandering veroorzaakt door onderstaande reactie:(1) 2 CH4 → C2H6 + H2
Bekend is dat de ΔrH van de verbranding van methaan tot CO2 en vloeibaar water (de HHV) ongeveer -891 kJ/mol methaan bedraagt (ca. 55 MJ warmte per kilogram methaan). Als nu ook de ΔrH van de verbranding van waterstof en ethaan (C2H6) bekend zijn, is de gevraagde ΔrH als volgt te berekenen op basis van onderstaande deelreacties:
(2) CH4 + 2 O2 → CO2 + 2 H2O
(3) H2O → H2 + 1/2 O2
(4) 2 CO2 + 3 H2O → C2H6 + 3 1/2 O2
Uit toepassen van de wet van Hess volgt:
ΔrH(1) = 2 · ΔrH(2) + ΔrH(3) + ΔrH(4)
Let hierbij op dat:
• ΔrH(2) = ΔrH(verbranding methaan)
• ΔrH(3) = - ΔrH(verbranding waterstof) (tekenwisseling, want reactie verloopt in omgekeerde richting van de verbrandingsreactie)
• ΔrH(2) = - ΔrH(verbranding ethaan) (tekenwisseling, want reactie verloopt in omgekeerde richting van de verbrandingsreactie)
Vormingsenthalpie
De vormingsenthalpie van een stof is de enthalpieverandering die veroorzaakt wordt door de reactie waarbij de betreffende stof het product is en de reactanten bestaan uit de elementen (koolstof, waterstof, zuurstof, ...) in de juiste hoeveelheid molen om precies 1 mol van de betreffende stof te vormen.
De vormingsreactie van methanol (CH3OH) is bijvoorbeeld:
C + 2 H2 + 1/2 O2 → CH3OH
In tabellenboeken zijn de vormingsenthalpieën (in [kJ/mol]) te vinden voor de vorming van stoffen bij standaardcondities. Dit worden de standaard vormingsenthalpieën genoemd en deze zijn te herkennen aan de 0 bij het symbool, bijv. zoals in ΔfH0. Aangezien het bij vormingsenthalpieën gaat om de enthalpieverandering als gevolg van de vorming van de stof uit de elementen, zijn de vormingsenthalpieën van de elementen zelf per definitie gelijk aan nul!
Afhankelijk van het element is het element bij 25 °C, een veelgebruikte standaardtemperatuur, een gas (bijv. zuurstof), een vloeistof (bijv. kwik) of een vaste stof (bijv. zwavel).
De vormingsenthalpieën kunnen gebruikt worden om de reactie-enthalpie te berekenen. Dit is een toepassing van de wet van Hess.
Berekening vormingsenthalpie uit bindingsenthalpieën
Op dezelfde manier als de reactie-enthalpie berekend kan worden uit de vormingsenthalpieën van de reactanten en producten kan de vormingsenthalpie van een verbinding berekend worden uit de bindingsenthalpieën van de bindingen die verbroken en gevormd worden tijdens de reactie waarbij de betreffende verbinding gevormd wordt uit de elementen waaruit deze verbinding bestaat. De vormingsenthalpie van methaan kan dus berekend aan de hand van de reactievergelijking:C(s) + 2 H2(g) → CH4(g)
en is gelijk aan: 4 · ΔHC-H vormen minus 2 · ΔHH-H verbreken, maar omdat koolstof een vaste stof is moet hier nog de sublimatie-energie van C(s) naar C(g) bij opgeteld worden.
De bindingsenthalpieën van bindingen zijn te vinden in tabellenboeken. Bij het maken van een binding komt warmte vrij, bindingsenthalpieën hebben dus een negatieve waarde. Voor het verbreken van bindingen moet de tegengestelde waarde van de bindingsenthalpie genomen worden; het verbreken van een binding kost energie, de enthalpieverandering is een positieve waarde.
Het aantal atoombindingen dat een atoom kan (en wil) aangaan, de covalantie van een atoom, verschilt per element. De covalentie van koolstof is vier en bij waterstof is de covalentie een. Mogelijke verbindingen bestaande uit alleen koolstof en waterstof zijn dan dus CH4, C2H6, C3H8 of in het algemeen CnH2n+2. Deze verbindingen worden alkanen genoemd. Tussen twee atomen kan ook een dubbele binding zitten, zoals bij C2H4 (etheen) waarbij de beide koolstofatomen met elkaar verbonden zijn door middel van een dubbele atoombinding. Ook driedubbele bindingen zijn mogelijk, bijvoorbeeld bij C2H2 (ethyn). De covalentie van stikstof is drie en van zuurstof twee, vandaar dat het NH3 en H2O is. Bij kooldioxide is het koolstofatoom door middel van twee dubbele bindingen met de zuurstofatomen verbonden. Voor de volledigheid: koolmonoxide heeft een driedubbele binding tussen beide atomen en wijkt hiermee af van de covalentievoorkeur.
Energiesysteemanalyse
Bij een energiesysteemanalyse wordt de informatie van de voorgaande pagina's van dit webdictaat toegepast. Denk hierbij aan het tekenen van een systeemdiagram inclusief in- en uitgaande stromen, het gebruik van massabalansen, het toepassen van de wet van behoud van energie, het berekenen van de reactiewarmte die vrijkomt, het wegkoelen van restwarmte etc etc.
Energiesysteemanalyses kunnen bijvoorbeeld worden gemaakt van een datahotel, van thermische centrales, maar ook van industriële systemen zoals een ammoniakfabriek. Een belangrijk aspect bij energiesysteemanalyses dat nog niet behandeld is, is het energierendement van thermische centrales. Traditionele steenkoolcentrales hebben bijvoorbeeld een lager energierendement dan moderne gascentrales.
Energiesysteemanalyse: voorbeeld datahotel
Datahotels verbruiken veel elektriciteit. Google heeft bijvoorbeeld in het Eemshavengebied in Noord-Groningen een datahotel in gebruik met daarin 100.000 servers. Elke server heeft een elektrisch vermogen van zo'n 0,3 tot 0,5 kW. Of de servers nu rekenen of wachten, de elektronica in de servers zet de toegevoerde elektriciteit om in warmte. Een eenvoudige energiebalans laat zien dat uit het gebouw dus continu warmte moet worden afgevoerd wil de temperatuur constant blijven:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = 0 $$
Een inventarisatie van alle stromen:
• Ein,1 = elektriciteit die naar de servers gaat
• Euit,1 = warmte die afgevoerd moet worden bij de servers
• Ein,1 = 100.000 ·0,5 kW (in dit geval wordt uitgegaan van het maximale vermogen) = 50 MW
Uit de energiebalans volgt dan:
• Euit,1 = 50 MW
Uitgaande van het maximale vermogen van de servers moet er dus continu 50 MW aan warmte worden afgevoerd.
Energiesysteemanalyse: voorbeeld ammoniakfabriek
Ammoniak, NH3, wordt wereldwijd op grote schaal geproduceerd als grondstof voor kunstmest. De uitvinding van het Haber-Bosch-proces (1908) voor de synthese van ammoniak uit stikstof was een doorbraak die relatief goedkope productie van stikstofkunstmest mogelijk maakte en in de decennia daarna heeft geleid tot sterke productiviteitsverhoging van de landbouw.
Ammoniak heeft een stookwaarde (LHV) van 19,9 MJ/kg. In een ammoniakfabriek wordt ammoniak gemaakt uit methaan CH4 en lucht. De volgende overall-reactie treedt op:
2 CH4 + N2 + 2 1/2 O2 → 2 NH3 + 2 CO2 + H2O
In het daadwerkelijke proces wordt eerst synthesegas gemaakt uit methaan met lucht, daaruit wordt CO2 verwijderd zodat een mengsel van N2 en H2 ontstaat dat kan reageren tot NH3. Deze laatste stap is het Haber-Bosch-procédé.
Vraag:
Als de stookwaarde (LHV) van methaan 50 MJ/kg bedraagt en aangenomen wordt dat er verder geen verliezen optreden, hoeveel warmte wordt er dan in de fabriek geproduceerd?
Het antwoord kan bepaald worden met een energiebalans. Wanneer aangenomen wordt dat de fabriek continu produceert geldt er:
$$ \ΣE_{\in,i} - \ΣE_{\uit,j} = 0 $$
Een inventarisatie van alle stromen (zie onderstaande figuur):
• inputs: methaan, lucht
• outputs: ammoniak, CO
Lucht, CO
$$ Q = φ_{\m,\methaan} · LHV_{\methaan} - φ_{\m,\ammoniak} · LHV_{\ammoniak} $$
Uit de reactievergelijking volgt dat er 1 mol NH3 per mol CH4 ontstaat. De molmassa's van methaan en ammoniak zijn respectievelijk ongeveer 16 en 17 g/mol, dus per kg geproduceerd ammoniak is er 16/17 kg methaan nodig en er geldt:
$$ φ_{\m,\methaan} = 16/17 · φ_{\m,ammoniak} $$
De geproduceerde hoeveelheid warmte per kg ammoniak is dan:
$$ {Q}/{φ_{\m,\ammoniak}} = 16/17 · LHV_{\methaan} - LHV_{\ammoniak} = {16}/{17} · 50 - 19,9 = 27,2 {\MJ}/{\kg \ammoniak} $$
In de fabriek ontstaat per kilogram ammoniak dus 27,2 MJ warmte(!). Of deze warmte nuttig kan worden benut hangt af van de inrichting van het industriële proces, de stand der techniek én of er potentiële gebruikers van deze warmte zijn op niet al te grote afstand van deze fabriek (wat meestal binnen een straal van 10 tot 25 km betekent).
Energierendement
Volgens de wet van behoud van energie moet voor elk systeem de energiebalans sluitend zijn. Voor een stationair systeem waarin geen accumulatie optreedt geldt:
$$ \ΣE_{in,i} = \ΣE_{\uit,j} $$
Het energierendement van het systeem is daarmee dus 100%! Hoe kan het dan dat er toch van energierendementen lager dan 100% gesproken wordt?
Dat kan alléén als de in- en uitgaande stromen een label gegeven wordt, bijvoorbeeld gewenst (energie)product, afvalwarmte, etc. Een grootschalige elektriciteitscentrale heeft bijvoorbeeld elektriciteit als gewenst, nuttig energieproduct. Het nuttig energierendement is dan:
$$ η = {\elektriciteitsproductie} / {φ_{\m,\brandstof} · LHV_{\brandstof} $$
Het is gebruikelijk om het over het energierendement te hebben, terwijl eigenlijk het nuttig energierendement bedoeld wordt. Verder worden bij energierendementsberekeningen de subschriften 'e' en 'th' gebruikt om aan te geven dat het om elektriciteit, respectievelijk warmte gaat. Zo wordt met ηe het elektrisch rendement en met ηth het thermisch rendement bedoeld. Ook gaat het bij de eenheden MWe en MWth om het elektrisch resp. thermisch vermogen. De eenheid MWth wordt niet alleen voor het thermisch (ingangs)vermogen gebruikt, maar ook voor het nominaal thermisch (uitgangs)vermogen: de hoeveelheid warmte die de installatie levert per tijdseenheid. Het is hier dus goed opletten welke van de twee bedoeld wordt.
Bij een centrale verwarmingsinstallatie is het nuttig energieproduct de hoeveelheid warmte afgegeven door de radiatoren. De energietoevoer van een CV-systeem bestaat uit de brandstof (in Nederland meestal aardgas van Groningen-kwaliteit). Het (nuttig) energierendement is dus:
$$ η = {Q_{\radiatoren}} / {φ_{\m,\aardgas} · LHV_{\aardgas}} $$
In veel gevallen kunnen de gegevens nodig om deze rendementen daadwerkelijk te berekenen afgeleid worden uit de gegevens die bekend zijn over het systeem. Daarbij kunnen massa- en energiebalansen gebruikt worden om ontbrekende gegevens te berekenen, zoals bij de berekening van het energierendement van een warmtekrachtcentrale.
Energierendement warmtekrachtcentrale
De warmtekrachtcentrale van E.ON in Rotterdam-Alexander levert warmte aan het stadsverwarmingsnet (huizen, winkels, kantoren). De installatie levert bij normaal bedrijf 250 MW aan het elektriciteitsnet en er verdwijnt 75 MW restwarmte met het rookgas. De centrale gebruikt 800 MW aan hoogcalorisch aardgas als brandstof.
Wat is het nuttig energierendement van de centrale?
Beantwoording
Gebruik hiervoor de systeembenadering:
1a. Lees de systeembeschrijving. Het gaat om een warmtekrachtcentrale dus in aanvulling op de stromen van beschrijving produceert de WKC ook nog nuttige warmte.
1b. Leg de systeemgrens om de WKC. Inventariseer alle stromen en teken het systeemdiagram (onderstaande tabel en figuur).
| Inputs | Outputs | ||
| Naam | Hoeveelheid [MW] | Naam | Hoeveelheid [MW] |
| aardgas | 800 | elektriciteit | 250 |
| lucht | 0 | nuttige warmte | ? |
| rookgas | 75 |
2. Eerste schatting van het antwoord is 80-90%.
3. Oplossingstrategie:
• Gevraagde rendement: η = (Eelektriciteit + Qnuttig) / (Eaardgas)
• Opstellen energiebalans: Eaardgas + Elucht = Eelektriciteit + Qnuttig + Q
4. Oplossing:
• Qnuttig = 800 MW + 0 MW - 250 MW - 75 MW = 475 MW
• η = (250 MW + 475 MW) / 800 MW = 91%
5. Controle: Het berekende antwoord klopt met de eerste schatting.
Merk hierbij op dat bij de bepaling van dit overall rendement de producten elektriciteit en warmte als gelijkwaardig worden beschouwd. In het vak TB242E, Processen in de energiesector, wordt behandeld dat elektriciteit en warmte volgens de 1e en 2e hoofdwetten van de thermodynamica verre van gelijkwaardig zijn.
Rendement van de warmtekrachtcentrale in de zomer
In de zomer is er veel minder vraag naar warmte van de huishoudens aangesloten op het stadsverwarmingsnet doordat ruimteverwaring in deze periode meestal niet nodig is en de huishoudens slechts warm tapwater gebruiken. Als er (zoals in dit geval) geen andere mogelijkheid is om de warmte als product af te zetten, wordt in deze periode een speciale restwarmtekoeler bijgeschakeld waarmee bij gelijkblijvende elektriciteitsproductie 90% van de geproduceerde warmte wordt weggekoeld. Hoe groot is in dit geval het energierendement van de WKC?Bij het doorlopen van dezelfde stappen als hierboven, komt naar voren dat er nu een extra energiestroom is, nl. Ekoelwater met een hoeveelheid van 0,9 · Qnuttig. Qnuttig,zomer is daarmee gelijk aan 0,9 · Qnuttig.
Het gevraagde energierendement wordt daarmee: ηzomer = (250 MW + 0,1 · 475 MW) / 800 MW = 37%
Bovenstaande is een voorbeeld van hoe met beschikbare gegevens relatief eenvoudig een eerste indruk gekregen kan worden van de stromen en het energierendement van een energieconversiesysteem door een 'black box'-benadering toe te passen.
Beschrijving van een elektriciteitscentrale met alleen een stoomcyclus
De eerste (kolengestookte) elektriciteitscentrales hadden alleen een stoomcyclus. Deze conventionele centrales produceren stoom door verbranding van een brandstof, waarna de stoom door een stoomturbine wordt geleid en er vervolgens door de daaraan gekoppelde generator elektriciteit geproduceerd wordt. Tegenwoordig worden vaak ook gasturbines toegepast, maar bijv. biomassacentrales en kerncentrales passen nog steeds alleen een stoomcyclus toe voor de omzetting van warmte in arbeid (elektriciteit). In onderstaande figuur is het principeschema van zo'n conventionele elektriciteitscentrale weergegeven. Het elektrisch rendement bedraagt zo'n 35 tot 40%.
Beschrijving conventionele elektriciteitscentrale:
• brandstof wordt met lucht verbrand. De chemische energie van de brandstof wordt omgezet in warmte Q (= ΔrH van de verbranding van de brandstof).
• een klein deel van deze warmte verlaat de centrale met het rookgas (Qrookgas).
• de overige warmte Qstoomcyclus = Q - Qrookgas wordt in een zogenaamde stoomcyclus omgezet in elektriciteit (arbeid, W) en restwarmte Q:
- een groot deel van de vrijgekomen verbrandingswarmte, Qstoomcyclus, wordt overgedragen aan water van hoge druk (typisch 120 bar), dat bij hoge druk en temperatuur verdampt tot hoge-druk stoom
- deze hoge-druk stoom drijft een (condenserende) stoomturbine aan, die een generator aandrijft waarmee elektriciteit, W, wordt opgewekt. In de turbine nemen de stoomdruk en temperatuur af.
- in de condensor wordt de afgewerkte stoom uit de turbine gecondenseerd bij lage druk. Dat is nodig om met weinig vermogen het water (als vloeistof) weer op hoge druk te kunnen brengen.
- dit water wordt met een pomp (niet weergegeven in het schema) weer op hoge druk gebracht en naar de warmtewisselaars in de verbrandingsoven gepompt.
• in de condensors van de elektriciteitscentrale wordt de afgewerkte stoom met koelwater (zeewater, rivierwater) gecondenseerd tot vloeibaar water. Het koelwater neemt daarbij een hoeveelheid warmte Qrestwarmte op. Deze Qrestwarmte = Qstoomcyclus - W (bij benadering, er zullen ook warmteverliezen naar de lucht zijn).
• een deel van de opgewekte elektriciteit W wordt in de centrale zelf gebruikt. Bijvoorbeeld voor het vermalen van de brandstof en voor de rookgasreiniging.
• voor de netto elektriciteitsproductie Wnetto geldt: Wnetto = W - Wintern verbruik
In het ideale (dus theoretische) geval is het energierendement van de stoomcyclus (η = Qstoomcyclus/W) gelijk aan het Carnot-rendement.
In aanvulling op de figuur is uit bovenstaande beschrijving duidelijk dat in deze stoomcyclus verschillende energieomzettingen optreden, zoals:
• verdamping: toevoer van warmte Q bij hoge temperatuur Th aan een vloeistof (water) onder hoge druk p > 100 bar. De warmte Q wordt overgedragen aan het water dat bij een iets lagere temperatuur Th - δT verdampt. Er geldt Q = ΔHverdamping.
• expansie: tijdens de expansie van hoge-druk stoom (hoge P, hoge T) naar lage druk en temperatuur wordt een deel van de enthalpie van deze stoom omgezet in arbeid W.
• condensatie: de enthalpie van de afgewerkte stoom wordt verder verlaagd door warmteafgifte aan het koelwater.
• compressie: verhoging van de enthalpie van het water door toevoer van arbeid via een (hoge-druk) pomp. De druk van het water neemt hierdoor toe.
De hierboven gegeven beschrijving geeft het principe weer van een elektriciteitscentrale. Het daadwerkelijke ontwerp van een moderne elektriciteitscentrale met alleen een stoomcyclus is complexer. In werkelijkheid kent het systeem bijvoorbeeld meerdere kwaliteiten stoom (p,T). Optimalisatie van het ontwerp vraagt dan om de keuze van enerzijds het aantal trappen in de stoomturbine en de bijbehorende temperatuur- en drukniveaus en anderzijds om verschillende warmtewisselaarsecties in het fornuis.
Beschrijving van een elektriciteitscentrale met (ook) een gasturbine
De eerste elektriciteitscentrales gestookt op aardgas hadden aanvankelijk hetzelfde systeemontwerp als de (steenkool)centrales met alleen een stoomcyclus, waarbij aardgas net als een vaste brandstof zoals steenkool of biomassa wordt verbrand in het fornuis om stoom te produceren waarmee een stoomturbine en generator aangedreven worden. In de jaren '60 van de vorige eeuw deed echter een nieuwe techniek zijn intrede in elektriciteitscentrales: de gasturbine.
Gasturbine
De gasturbine is afgeleid van de turbinemotor van een vliegtuig (zoals bekend van straalvliegtuigen). Een gasturbine-eenheid bestaat uit:• een compressor: verbrandingslucht wordt aangezogen en gecomprimeerd
• een verbrandingskamer: hierin worden brandstof en lucht gemengd en verbrand waarbij een sterke volumevergroting en temperatuurverhoging optreedt
• een expansieturbine: waarin een deel van de energie die is vrijgekomen tijdens de verbranding wordt omgezet in arbeid.
Aardgas wordt meestal al op druk aangeleverd. Typisch werkcondities van een gasturbine-eenheid zijn 10-16 bar en 1200 °C in de verbrandingskamer en 1 bar en 500 °C van de uitlaatgassen. Gasturbines hebben elektrische vermogens van 1-375 MW. Het elektrisch rendement van gasturbine-installaties bedraagt zo'n 20 tot 35%.
Zoals de naam al aangeeft, werkt een gasturbine-eenheid op gasvormige brandstoffen: aardgas, stadsgas, hoogovengas, biogas, synthesegas, LPG etc. Daarnaast is het, door toepassing van speciale branders en een hoge-druk brandstofpomp, mogelijk om vloeibare brandstoffen te gebruiken die dan als zeer kleine druppeltjes in de verbrandingskamer worden gespoten. Op deze manier is het mogelijk om relatief lichte koolwaterstoffen (benzine, kerosine, huisbrandolie) te gebruiken. Wel dient de gasturbine-eenheid daarop ontworpen te zijn om voldoende verblijftijd in de verbrandingskamer te garanderen. Is dat niet het geval dan zullen deze brandstoffen onvolledig verbranden, met de vorming van grote hoeveelheden roet en koolmonoxide (CO) tot gevolg.
Het rendement van een gasturbine-eenheid is relatief laag en de apparatuur is relatief duur, daardoor is 'stand-alone'-toepassing voor elektriciteitsproductie meestal geen optie. Een uitzondering op deze regel is de toepassing van gasturbine-eenheden voor het opvangen van de piekvraag in het elektriciteitsnet: alle grote elektriciteitsproductiebedrijven hebben wel één of meer gasturbine-eenheden voor dit doel geïnstalleerd. Dit zijn zgn. 'Open Cycle Gas Turbines' (OCGT): de verbrandingsgassen worden na de expansie direct geloosd in de atmosfeer. Deze eenheden maken jaarlijks meestal maar enige tientallen tot honderden draaiuren doordat ze worden ingezet om pieken in de elektriciteitsvraag op te vangen en in te spelen op gunstige prijsschommelingen in de elektriciteitsmmarkt. Daarvoor zijn ze bij uitstek geschikt: een gasturbine-eenheid die op 'stand-by' staat kan in zeer korte tijd op vol vermogen elektriciteit aan het net leveren.
Vanzelfsprekend moeten gasturbine-eenheden voldoen aan alle milieu-eisen om luchtverontreiniging (met name NOx- en CO-uitstoot) te beperken, en zullen er voorzieningen moeten zijn om de restwarmte in de uitlaatgassen op een verantwoorde manier in de atmosfeer te lozen.
Moderne gascentrale
De ontwikkeling van grote, betrouwbare gasturbines bood de mogelijkheid om gasturbine-eenheden te integreren in de conventionele gascentrales (waarbij aardgas net als een vaste brandstof verbrand wordt om stoom te produceren). De gasturbine-eenheid wordt bij deze gasgestookte combi-eenheden gebruikt om de verbrandingslucht voor het fornuis van de conventionele gascentrale te leveren. In de jaren '80 van de vorige eeuw zijn zo de bestaande aardgascentrales in Nederland aangepast, waarbij een rendementsverbetering van zo'n 4% werd bereikt en het elektrisch rendement op zo'n 40 tot 45% uitkomt.Deze configuratie is mogelijk omdat een gasturbine-eenheid werkt met een grote overmaat verbrandingslucht. Dit betekent dat in de uitlaatgassen van een gasturbine nog veel zuurstof aanwezig is, meestal zo'n 10-12 vol.%, wat ruim voldoende is om in het nageschakelde fornuis nog eens een hoeveelheid brandstof om te zetten en met de vrijkomende warmte stoom te produceren. Deze hoge-drukstoom wordt vervolgens net als in een conventionele centrale naar een stoomturbine/generator-combinatie geleid om elektriciteit op te wekken.
Tegenwoordig wordt voor nieuw ontworpen aardgascentrales bijna zonder uitzondering het STEG (SToom En Gasturbine)-principe gebruikt, waarbij er voor de stoomcyclus geen extra brandstof meer wordt verbrand maar de hete uitlaatgassen van de gasturbine rechtstreeks worden gebruikt om stoom te produceren. Deze STEG-centrales halen elektrische rendementen van 55 tot 60%.
De Eemscentralew combineert beide systeemconcepten. In 1988 werd een bestaande aardgasgestookte eenheid aangepast door plaatsing van een aan het fornuis voorgeschakelde gasturbine-eenheid. Deze combi-eenheid heeft daarmee een vermogen van 675 MWe. In 2001 zijn vijf moderne STEG eenheden van elk 350 MWe in bedrijf gekomen. Met een gasturbine-eenheid van 17 MWe brengt dit het totale elektrisch vermogen van de centrale op 2442 MWe.
Kerncentrales
Een kerncentrale is een voorbeeld van een thermische centrale: de warmte die vrijkomt bij kernreacties wordt gebruikt om stoom te produceren waarmee een stoomturbine en generator aangedreven worden.
Een overzicht van de locaties van kerncentrales en andere types elektriciteitscentrales in Europa is hierw te vinden. Een land dat grotendeels met kernenergie in zijn elektriciteitsbehoefte voorziet is Frankijk. De enige kerncentrale van Nederlandw staat in Borssele en heeft een vermogen van 485 MWe. Het rendement, betrokken op de in de nucleaire reactor gegenereerde warmte uit kernreacties, is zo'n 37%.
Bestaande kerncentrales passen kernsplijting toe en gebruiken uranium als splijtstof. Voor een beschrijving van de werking en onderdelen van moderne kerncentrales wordt verwezen naar deze paginaw, die ook onderdeel is van de leerstof. Hetzelfde geldt voor deze beschrijvingw van een toekomstig type kerncentrale.
Nucleaire energie (kernsplijting, kernreactoren) wordt enerzijds geafficheerd als schoon (bij de kernreacties zelf komt geen CO2 vrij), veilig en duurzaam bij gebruik van reactoren van de derde of vierde generatie. Anderzijds is kernenergie controversieel door de risico's op ongelukken, het vrijkomen van ioniserende ('radioactieve') straling, de mogelijke productie en het gebruik van splijtstof voor atoomwapens. Daarnaast produceert elke kernreactor onvermijdelijk een hoeveelheid radioactief afval die een (lange) tijd veilig moet worden opgeslagen. Delta vroeg twee Delftse professoren waarom we in 2050 (g)een kernreactor nodig hebbenw.
Kernreacties
Bij atoomkernreacties zijn er interacties tussen atomen (al dan niet in moleculen) en straling, andere atomen of subatomaire deeltjes.
Er is sprake van kernsplijting als grotere, zware atomen uiteenvallen in kleinere atomen. De basis van de meeste kernreactoren voor elektriciteitsproductie is de splijting van het isotoop uranium-235 door kernreactie met een neutron (n), bijvoorbeeld volgens de reactie:
23592U + 10n → 14456Ba + 8936Kr + 3 10n
Verspreid over de aarde wordt uraniumertsw gevonden. De uranium die zich daarin bevindt is voor het overgrote deel U-238 en maar voor een heel klein deel U-235. Doordat van elke element, dus ook van uranium, de isotopen zich chemisch precies gelijk gedragen, kunnen U-235 en U-238 slechts gescheiden worden op basis van hun verschil in massa (en dichtheid). Via een keten van processenw wordt daartoe uraniumoxide UO2 geïsoleerd uit uraniumerts en chemisch omgezet in uraniumhexafluoride UF6. In speciale ultracentrifuges die met zeer hoge toerentallen werken, worden vervolgens 235UF6 en 238UF6 gescheiden, waarna vervolgens uraniumoxide met een hoger gehalte aan U-235 geproduceerd kan worden.
Bij kernfusiereacties, zoals die plaatsvinden in de zon, smelten lichte atoomkernen (waterstof) samen tot iets zwaardere atomen (helium). De kernfusiereactie die onderzocht wordt voor toepassing in kernfusiereactoren is die waarbij twee vormen van zwaar waterstof, te weten deuterium 21H en tritium 31H, samensmelten tot helium:
21H + 31H → 42He + 10n
Er wordt internationaal onderzoek gedaan, de ITERw-samenwerking, naar de technische haalbaarheid van kernfusie. In Cadarache (Zuid-Frankrijk) wordt door ITER een tokamakw-onderzoeksreactor gebouwd. De uitdaging bij kernfusie is om bij de fusiereactie meer energie vrij te laten komen dan nodig is om het daarvoor benodigde plasma van zeer hoge temperatuur tot stand te brengen. Een voordeel van kernfusie ten opzichte van kernsplijting is dat bij kernfusie geen radioactief afval ontstaat, maar dat alleen de reactorwand licht radioactief wordt. Deze radioactiviteit is na relatief korte tijd voorbij, namelijk na zo'n 150 jaar.
Atomen
Atomen zijn opgebouwd uit een drietal typen subatomaire deeltjes: de atoomkern is opgebouwd uit protonen en neutronen (behalve bij waterstof). Protonen zijn positief geladen en neutronen zijn ongeladen subatomaire deeltjes. Rond de kern bevindt zich conform het atoommodel van Rutherford een wolk van elektronen, negatief geladen deeltjes. Een animatie van dit atoommodel is hierw te vinden.
De massa van een atoom, de atoommassa, bevindt zich in de atoomkern en wordt bepaald door het aantal protonen en neutronen in die kern. De som van het aantal protonen en neutronen wordt het massagetal genoemd. Een elektron heeft weliswaar ook een massa, maar die is nagenoeg verwaarloosbaar ten opzichte van de massa van protonen en neutronen. De massa's van protonen en neutronen zijn nagenoeg gelijk en de massa van een proton is gelijkgesteld aan 1 u (de atomaire massaeenheid). Onderstaande tabel geeft een overzicht van de massa en lading van de drie typen subatomaire deeltjes.
| deeltje | massa [kg] | lading |
| elektron | 9,11 · 10-31 | -1 |
| proton | 1,673 · 10-27 | 1 |
| neutron | 1,675 · 10-27 | 0 |
Bij isotopen van een element verschilt het aantal neutronen en daarmee dus ook de atoommassa en het massagetal. Voorbeelden zijn U-235 en U-238.
Isotopen
Het periodiek systeem der elementenw is een systematisch overzicht van alle bekende scheikundige elementen en geeft informatie over onder andere het aantal protonen in de kern en de massa van atomen. Het aantal protonen in de kern wordt het atoomnummer of atoomgetal genoemd en staat linksonder voor het symbool van het element. Elk element heeft een eigen atoomnummer. De massa van een atoom, de atoommassa, staat linksboven voor het symbool van het element, bijvoorbeeld 168O.
Van de meeste elementen bestaan meerdere isotopen. Deze isotopen hebben hetzelfde aantal protonen en elektronen, maar een verschillend aantal neutronen in de kern. De gemiddelde atoommassa opgenomen in het periodiek systeem is bepaald voor de natuurlijk voorkomende mix van isotopen voor elk element. Van koolstof, C, bestaan bijvoorbeeld 12C, 13C en 14C isotopen met een atoommassa van respectievelijk 12, 13 en 14 u. De gemiddelde atoommassa van koolstof is 12,01 u doordat het aandeel 13C en 14C zeer klein is. Chloor (Cl) heeft een opvallende atoommassa van 35,45 u. De verhouding tussen de isotopen 35Cl en 37Cl in de natuur is blijkbaar ongeveer 3:1.
Veel isotopen zijn niet stabiel; ze vallen spontaan uiteen. Dit radioactief verval verloopt exponentieel. Elk instabiel isotoop heeft een karakteristieke halfwaardetijd. De halfwaardetijd van U-235 is bijvoorbeeld 704 miljoen jaar.
Lucht
Bij het vak TB142E wordt ervan uitgegaan dat lucht voor 79 volumeprocent uit stikstof, N2, en 21 volumeprocent uit zuurstof, O2, bestaat, maar in werkelijkheid is de samenstelling van lucht veel complexer. Zo bevat lucht 1 tot 5 volumeprocent waterdamp, bijna 1 volumeprocent argon (Ar), het bekende broeikasgas CO2 en verder onder andere neon, methaan, helium, ozon en stikstofdioxide. Daarnaast bevat lucht, helaas, verontreinigingen.
Ideaal gaswet
De dichtheid van lucht bij atmosferische druk en kamertemperatuur kan bij benadering berekend worden met de ideaal gaswet.
$$ pV = nRT $$
met:
$p$ = absolute druk [Pa]
$V$ = volume [m3]
$n$ = aantal mol van de stof [mol]
$R$ = universele gasconstante [8,314 J/molK]
$T$ = absolute temperatuur [K]
Uit de ideaal gaswet volgt dat V/n, het molaire volume, afhankelijk is van de druk en de temperatuur en dat bij een bepaalde druk en temperatuur geldt dat volumepercentages en molpercentages aan elkaar gelijk zijn.
Voor de dichtheid van lucht geldt dat deze gelijk is aan het aantal mol per volume-eenheid maal de molmassa. Toepassen van de ideaal gaswet geeft:
$$ ρ = {pM}/{RT} $$
Luchtverontreiniging
Thermische centrales veroorzaken luchtverontreiniging door onder andere de verontreinigingen die zich bevinden in de brandstoffen die deze centrales gebruiken. Voorbeelden van verontreinigingen zijn zwavel, stikstof, (zware) en giftige metalen. Zonder maatregelen worden deze bij de winning en de latere verbranding van de brandstof uitgestoten als vluchtige emissie naar de atmosfeer of blijven ze achter als vast restproduct (bodemas, vliegas). Afhankelijk van de brandstof en de hoeveelheid zuurstof kunnen er ook emissies ontstaan ten gevolge van onvolledige verbranding (koolmonoxide, koolwaterstoffen). Daarnaast kan er luchtverontreiniging ontstaan ten gevolge van de vuurhaardcondities (temperatuur en zuurstofconcentratie).
Aardgas
• stikstofoxides, NOx: zogenaamde 'brandstof-NOx' ontstaat uit de in de brandstof aanwezige stikstof (Gronings gas). Daarnaast kan er 'thermische NOx' ontstaan als gevolg van de vuurhaardcondities. Bij verbranding met lucht is er immers N2 uit de lucht aanwezig, de verbrandingstemperatuur is hoog, en het rookgas verblijft enige tijd in de installatie bij condities gunstig voor de vorming van NOx. Zonder verdere technische voorzorgsmaatregelen produceert een gasturbine-eenheid veel 'thermische NOx'.Biomassa
Voorbeelden van luchtverontreiniging door het gebruik van biomassa als brandstof zijn:• roet: door onvolledige verbranding van de biomassa
• NOx: bij de verbranding van biomassa kan zowel brandstof- als thermische NOx ontstaan.
• zwaveldioxide, SO2: ontstaat door de oxidatie van in de biomassa aanwezige zwavel (S) en is afhankelijk van het zwavelgehalte van de biomassa. SO2 is samen met NOx de belangrijkste veroorzaker van zure regen.
Steenkool
Steenkool is niet alleen een brandstof die relatief veel verontreinigingen bevat, de verbranding van steenkool leidt ook tot de vorming van heel fijne roetdeeltjes. De belangrijkste verontreinigingen in onbehandeld rookgas van kolencentrales zijn:• roet: ontstaat door nooit 100% volledige 'uitbrand' van poederkooldeeltjes en de aanwezigheid van as.
• SO2: is afhankelijk van het zwavelgehalte van de steenkool, dat kan oplopen tot 7 massa% bij hoogzwavelige steenkoolsoorten. Ook bij de verbranding van zwavelhoudende zware stookolie komt zwaveldioxide vrij.
• NOx: uit de in steenkool aanwezige stikstof (het stikstofgehalte van steenkool loopt uiteen van 0,2 tot 2 massa%) ontstaat 'brandstof-NOx'. Vanwege de extreme condities in haar verbrandingskamer én de aanwezigheid van N2 in lucht produceert een kolencentrale zonder technische voorzorgsmaatregelen daarnaast veel thermische NOx.
• anorganische vluchtige metaalverbindingen zoals tinchloride (SnCl4). Deze verbindingen zijn vluchtig bij de temperaturen die bereikt worden in de centrale. Buiten de centrale zullen ze door hun soortelijk gewicht in de buurt van de centrale neerslaan. Zware metalen als Sn zijn giftig. Metalen kunnen zich ook hechten aan de roetdeeltjes die bij de verbranding ontstaan.
Waterstof
• NOx: als gevolg van de vuurhaardcondities kan er 'thermische NOx' ontstaan.Rookgasreiniging
In de loop der tijd zijn verschillende rookgasreinigingstechnieken ontwikkeld om dit soort luchtverontreiniging te voorkomen. Wereldwijd is deze ontwikkeling van technologie gepaard gegaan met steeds strengere normen voor (nog toelaatbare) uitstoot.• roetfilters: tegenwoordig bestaat dit (bij een steenkoolcentrale) vaak uit twee of drie gedeeltes: een doekenfilter, cycloon en/of elektrostatisch filter. Dit zijn grote installaties omdat een grote hoeveelheid rookgas moet worden gefilterd.
• NOx-verwijdering: in veel landen is het verplicht de NOx-uitstoot van (kolen)centrales te beperken door toepassing van zgn. low-NOx-branders. Bij steenkoolverbranding wordt hiermee een reductie van ca. 30% bereikt.
Bij gascentrales kan water of stoom in de verbrandingskamer worden geïnjecteerd: een stoomgeïnjecteerde gasturbine-eenheid (of STIG, niet te verwarren met een STEG-installatie (Stoom- En GasTurbine)). Dit is een voorbeeld van een zogenaamde procesgeïntegreerde oplossing: door voorzieningen te treffen ín de technische installatie wordt de vorming van NOx voorkomen.
Een andere techniek die bij gascentrales, en in mindere mate bij kolencentrales, wordt toegepast is selectieve katalytische reductie (SCR) van NOx in het rookgas met behulp van NH3. Hierbij wordt ammoniak (NH3), al of niet op een fijn maas van katalysator, in het rookgas gesproeid zodat de NOx wordt gereduceerd tot stikstof:
- 2 NH3 + 2 NO + 1/2 O2 → 2 N2 + 3 H2O
- 4 NH3 + 2 NO2 + O2 → 3 N2 + 6 H2O
Dit is een nageschakelde of 'end-of-pipe'-techniek waarmee zeer lage NOx-concentraties kunnen worden bereikt.
• SO2-verwijdering. Dit gebeurt gewoonlijk door het rookgas door een kalkmelkoplossing (CaO, water) te leiden, waarbij de volgende reacties optreden:
- kalkmelk: CaO + H2O → Ca2+ + 2 OH-
- SO2-absorptie: SO2 + OH- → HSO3- en HSO3- + OH- → SO32- + H2O
- vorming sulfiet: SO32- + Ca2+ → CaSO3
In veel installaties wordt vervolgens het calciumsulfiet (CaSO3) geoxideerd tot calciumsulfaat (CaSO4): CaSO3 + 1/2 O2 → CaSO4, dat vervolgens met water neerslaat tot CaSO4.2H2O.
Een andere mogelijkheid bij steenkoolcentrales is om CaO bij te mengen bij de poederkool. De voorgaande reacties treden dan op in de vuurhaard en CaSO4 wordt afgevoerd met de slakken. Echter, een deel van de zwavel zal dan nog steeds in het rookgas eindigen.
• Vluchtige metaalverbindingen (bij kolencentrales) worden als het goed is afgevangen door de combinatie van bovenstaande technieken daarop in te richten.
Primaire luchtverontreiniging
De stoffen die enerzijds door natuurlijke oorzaken, anderzijds door menselijke activiteiten in de atmosfeer komen, worden primaire luchtverontreiniging genoemd. Het gaat dan om:• koolmonoxide (CO)
• kooldioxide (CO2)
• zwaveldioxide (SO2)
• stikstofoxiden (NOx)
• ammoniak (NH3)
• vluchtige organische stoffen (bijv. benzeen, ethanol, formaldehyde)
• zware metalen
• roet en aerosolen
Dit zijn allemaal in principe meetbare outputs van ons systeem. In Nederland is vanaf de jaren '80 een emissieregistratiesysteem opgezet om de hoeveelheid emissies in Nederland te monitoren. Volgens het Compendium voor de Leefomgevingw zijn de emissies van zwaveldioxide, stikstofoxiden en ammoniak sterk afgenomen sinds 1990, zie onderstaande figuur, en voldoen ze in 2021 aan de relatieve reductiedoelstellingen voor de periode 2020-2029.
Met uitzondering van CO2 zijn deze stoffen ook relevant voor waterverontreiniging. Ammoniak, zware metalen en roet komen (deels) rechtstreeks door uitwassing in watersystemen terecht.
Secundaire luchtverontreiniging
Secundaire luchtverontreiniging is een verzamelterm voor vormen van luchtverontreiniging die via verschillende routes ontstaan door een reactie tussen de stoffen behorend tot primaire luchtverontreiniging of door een reactie met andere stoffen die al aanwezig zijn in de atmosfeer. Zo worden SO2 en NOx bijvoorbeeld omgezet in zwavelzuur (H2SO4) resp. salpeterzuur (HNO3) en verlaten de atmosfeer vervolgens in de vorm van zure regen. Andere voorbeelden van secundaire luchtverontreiniging zijn ozon in de troposfeer en secundair fijnstof, dat vooral ontstaat uit NOx, NH3 en SO2 (IPLO (z.d.)).Ontstaan van secundaire luchtverontreiniging
Uit primaire luchtverontreiniging onstaat via verschillende routes secundaire luchtverontreiniging:
• fotochemische reacties (reacties aangedreven door energierijke zonnestraling)
• oplossing en reactie in waterdamp in de atmosfeer
Bij deze fotochemische reacties speelt het hydroxylradicaal (•OH) een belangrijke rol. Hydroxylradicalen worden in een schone atmosfeer onder invloed van licht gevormd uit ozon en water:
O3 — hν→ O2 + O•
O• + H2O → 2 •OH
Er worden maar zeer weinig hydroxylradicalen gevormd in de atmosfeer, maar doordat ze erg reactief zijn spelen ze een hoofdrol bij de verwijdering van SO2, NOx en CO uit de atmosfeer. De verwijdering van NOx (NO en NO2) verloopt als volgt:
NO + O• → NO2
NO2 + •OH → HNO3
De verwijdering van SO2 verloopt vergelijkbaar:
SO2 + •OH → HSO3•
HSO3• + O2 + H2O → H2SO4 + HO2•
In de laatste reactie wordt een hydroperoxylradicaal (HO2•) gevormd, dat bijvoorbeeld met zuurstof tot ozon en een nieuw hydroxylradicaal reageert:
HO2• + O2 → •OH + O3
Ten slotte reageert koolmonoxide ook met een hydroxylradicaal tot kooldioxide en een waterstofradicaal, dat direct met water reageert:
CO + •OH → CO2 + H•
H• + H2O → •OH + H2
De verwijdering van SO2 en CO met hydroxylradicalen loopt dus door totdat er geen SO2 en/of CO meer aanwezig is. Immers, het hydroxylradicaal wordt steeds, via het hydroperoxylradicaal, teruggevormd en fungeert als het ware als chemisch katalysator van de omzetting van SO2 en/of CO.
De voorgaande cyclus van reacties kan verder worden geïntensiveerd door de aanwezigheid van sporen van bepaalde metalen, zoals ijzer (Fe) en mangaan (Mn). De tweewaardige ionen van deze metalen, Fe2+ en Mn2+ zijn erg reactief. De volgende serie reacties treedt op met ijzer:
2Fe2+ + 2H+ + O2 → 2Fe3+ + H2O2
Fe2+ + H+ + H2O2 → Fe3+ + •OH + H2O
Behalve de eerder beschreven reactie van het hydroperoxylradicaal met zuurstof kan het hydroperoxylradicaal ook uiteenvallen in zuurstof en waterstofperoxide:
2 HO2• — hν→ O2 + H2O2
Uiteindelijk wordt de cirkel rond gemaakt door reductie van het ijzer onder invloed van licht:
Fe3+ + OH- — hν→ Fe2+ + •OH
Dit illustreert hoe kleine hoeveelheden metalen in de atmosfeer kunnen leiden tot een fotochemische cyclus die hydroxylradicalen produceert die er op hun beurt weer voor zorgen dat CO, SO2 en NOx in de atmosfeer worden omgezet. De geproduceerde H2SO4 en HNO3 lossen op in water, waarmee zure regen een feit is. Volgens het Compendium voor de Leefomgevingw is de verzurende depositie in Nederland sinds 1990 met 55% afgenomen, zie onderstaande figuur, en is dat vooral te danken aan vermindering van de uitstoot van zwaveldioxide.
Fotochemie
Fotochemie is chemie die plaatsvindt onder invloed van licht, met andere woorden: fotochemische reacties worden aangedreven door licht. Fotochemische reacties spelen een belangrijke rol bij de afbraak van de ozonlaag, het ontstaan van fotochemische (zomer)smog en bij het natuurlijke proces waarmee de atmosfeer voortdurend wordt ontdaan van luchtverontreiniging.
De naam 'foto...' is afgeleid van de samenstellende delen van licht: de fotonen. Licht is straling en die straling is gekwantificeerd in pakketjes, fotonen. Een foton heeft een vaste hoeveelheid energie:
Efoton = h · ν
met:
h = constante van Planck [Js] (= 6,6 · 10-34 Js)
ν (uitspraak 'nu') = frequentie van de straling [s-1]
De energie van één foton is heel klein, maar dit is anders voor een mol fotonen. Als de energie van een mol fotonen groter is dan of gelijk is aan bijvoorbeeld de bindingsenthalpie van de O-H-binding in water, dan kunnen deze fotonen (in principe) deze binding splitsen.
In stabiele organische moleculen zoals methaan (CH4), ethyleen (H2C=CH2) en acetyleen (HC≡CH) zijn alle elekronen gepaard. In de structuurformule stelt elk streepje één elektronenpaar voor. Bij ethyleen staan er twee streepjes tussen de koolstof-atomen, het is een dubbele binding, en bij acetyleen zijn het er drie, een driedubbele binding. In het bal- en staafmodel in onderstaande figuur is ook te zien dat de C-H-bindingen steeds enkelvoudig zijn, maar dat de koolstof-koolstof-binding tweevoudig (ethyleen) respectievelijk drievoudig (acetyleen) is.
Bij een fotochemische splitsingsreactie van een organisch molecuul AB ontstaan in eerste instantie twee brokstukken met elk één ongepaard elektron:
AB — hν→ A• + B•
Bovenstaande vergelijking geeft aan hoe in de chemie radicalen worden weergegeven. Een atoom of molecuul met een ongepaard elektron wordt een radicaal genoemd, voorbeelden van radicalen zijn hydroxyl- en hydroperoxylradicalen. De naam radicaal is gekozen omdat deze deeltjes zeer reactief zijn. Ze hebben meestal een zeer korte levensduur. Ten opzichte van moleculen met alléén gepaarde elektronen vertegenwoordigt een radicaal een hogere energietoestand. Als het radicaal reageert (met een ander radicaal) zal de energietoestand van de combinatie lager zijn.
De snelheid van radicaalreacties kan zeer hoog zijn doordat er voor de vorming van elektronenparen geen belemmeringen zijn anders dan de aanwezigheid van andere radicalen en de ruimtelijke configuratie van deze radicalen (terminatie) of de aanwezigheid van andere moleculen waarmee de radicalen kunnen reageren (propagatie). Radicaalreacties hebben daardoor geen of een zeer lage activeringsenergie, met andere woorden: de kans dat een reactie optreedt is groot.
Als onder invloed van licht eenmaal een radicaal is gevormd dan kan een keten van radicaalreacties volgen, afhankelijk van de chemische samenstelling van het mengsel dat reageert (c.q. de cocktail van verontreinigingen aanwezig in de atmosfeer). Een algemeen schema is bijvoorbeeld:
AB — hν→ A• + B•
A• + CD → AC + D•
D• + E → DE•
etc.
Een veel voorkomend mechanisme is een ketenreactie waarin het radicaal als het ware als katalysator fungeert (een katalysator is een stof of materiaal dat een (chemische) reactie mogelijk maakt en/of versnelt, zonder dat ze zelf wordt verbruikt tijdens het verloop van de versnelde reactie). In dit soort reactiecycli wordt het radicaal steeds teruggevormd, waarna het radicaal een nieuwe reactie mogelijk kan maken. Zo'n katalytische keten bestaat uit drie types radicaalreacties: initiatie-, propagatie- en terminatie(reacties). Bij fotochemie verloopt de initiatie onder invloed van licht. Propagatie- en terminatiereacties kunnen onder invloed van licht verlopen, maar dat hoeft niet:
initiatie: X — hν→ X• + e-
propagatie 1: X• + R-B → R-X• + B
propagatie 2: R-X• + C → R-C + X•
terminatie: X• + X• → X2
Het bovenstaande schema is het eenvoudigst denkbare schema: de keten wordt onder invloed van licht geïnitieerd door vorming van radicaal X•, het radicaal reageert met stof RB tot radicaal RX• en stof B, het nieuwe radicaal attaqueert een derde molecuul C waarmee het stof RC vormt en radicaal X• wordt teruggevormd. Deze cyclus zet zich eindeloos voort totdat stof RB of stof C is uitgeput. De cyclus wordt vertraagd door het optreden van een terminatiereactie. Er zijn vele varianten op dit schema, onder andere te zien bij de vorming van fotochemische smog (vervuiling van lucht met o.a. ozon, wat irriterend is voor de luchtwegen) en de afbraak van de ozonlaag.
De industrie gebruikt radicaalpolymerisatie voor bijvoorbeeld de productie van bepaalde soorten plastics. De initiatie vindt dan niet plaats door licht, maar door toevoeging van een speciaal initiatormolecuul dat gemakkelijk uiteenvalt onder levering van een radicaal. De omgekeerde situatie komt ook voor: toevoeging van radicaalvangers om de katalytische keten van reacties te vertragen of te voorkomen. De werking van vitamine C wordt bijvoorbeeld wel toegeschreven aan het vermogen van dit molecuul om vrije radicalen in het menselijk lichaam in te vangen voordat deze (schadelijke) ketenreacties in gang zetten.
Afbraak ozonlaag
De ozonlaag bevindt zich op ongeveer 15 tot 50 km hoogte in de stratosfeer en beschermt het leven op aarde tegen schadelijke, energierijke UV-A- en UV-B-straling. De fotonen van deze straling zijn zo energierijk dat ze DNA kunnen beschadigen wat tot huidkanker kan leiden. UV-B kan ook een groot effect hebben op de algenpopulatie in de oceanen en daarmee op de zuurstofhuishouding van de aarde en het leven in de wereldzeeën: algen en plankton staan immers aan de basis van alle voedselketens in zee.
Ozon in de ozonlaag wordt zowel gevormd als afgebroken onder invloed van zonlicht. Beide reacties vangen schadelijke UV-straling af zodat deze de aarde niet bereikt.
splitsing zuurstof: O2 — hν < 242 nm→ 2 O•
vorming ozon: O• + O2 + M → O3 + M
afbraak ozon: O3 — hν 200-320 nm→ O2 + O•
afbraak ozon: O3 + O• → 2 O2
In de vormingsreactie van ozon is een derde molecuul, M, nodig om een deel van de reactie-energie af te voeren. Molecuul M kan bijvoorbeeld stikstof of een ander zuurstofmolecuul zijn. Uiteindelijk zal zich al naar gelang de snelheid van deze reacties en de hoeveelheid zonnestraling een evenwicht instellen. Let erop dat het zuurstofradicaal O• een rol speelt bij zowel de opbouw- als de afbraakreactie.
Een tweede, natuurlijk afbraakmechanisme van ozon in de ozonlaag verloopt via het hydroxylradicaal, dat in de troposfeer gevormd kan worden uit zuurstofradicalen die reageren met water:
propagatie 1: H2O + O• — hν→ 2 HO•
propagatie 2: HO• + O3 → H2O + O2
Invloed van CFK's
In de jaren '70 van de twintigste eeuw werd duidelijk dat de ozonlaag geleidelijk dunner werd. Er werd ontdekt dat de uitstoot van chloorfluorkoolwaterstoffen (CFK's) leidt tot aanwezigheid van chloor- en fluorradicalen in de stratosfeer. Dat komt weer doordat CFK's ontworpen zijn om chemisch stabiel te zijn: als ze worden uitgestoten, bijvoorbeeld als een koelkast zijn koelvloeistof lekt, blijven ze zeer lang in de atmosfeer zonder af te breken. In die tijd migreren de moleculen langzaam naar de stratosfeer. Een deel van de uitgestoten CFK's komt uiteindelijk ongeschonden aan in de ozonlaag. Eenmaal daar aangekomen worden ze onder invloed van zonlicht een bron van halogeenradicalen. Deze chloor- en fluorradicalen leiden tot een keten van afbraakreacties waarmee de balans van fotochemische opbouw- en afbraakreacties van de ozonlaag wordt verstoord en zich uiteindelijk een nieuwe, fors lagere evenwichtsconcentratie van ozon zal instellen.
Het schema is bijna identiek aan het algemene schema voor een radicaal-ketenreactie. Voor een CFK R-Cl die chloorradicalen levert, zijn de reacties als volgt:
initiatie: R-Cl — hν→ R• + Cl•
propagatie 1: Cl• + O3 → ClO• + O2
propagatie 2: ClO• + O• → Cl• + O2
terminatie: Cl• + Cl• → Cl2
Aan dit schema is te zien dat de chloorradicalen op twee manieren aangrijpen op de natuurlijke opbouw- en afbraakreacties van ozon: enerzijds door ozon af te breken via propagatiereactie 1, anderzijds door gebruik te maken van het zuurstofradicaal O• in propagatiereactie 2, waarbij het chloorradicaal wordt teruggevormd. Voor fluor verloopt het schema identiek.
CFK's zijn de belangrijkste oorzaak van de afbraak van de ozonlaag. Vanwege de grote bedreiging is de wereld snel in actie gekomen. Al in 1979 werd het in de Verenigde Staten verboden om CFK's als drijfgas te gebruiken in spuitbussen. In 1987 werd het Verdrag van Montreal gesloten, dat gericht is op het uitfaseren van CFK's en andere gechloreerde, fluor- en broomkoolwaterstoffen die een bedreiging vormen voor de ozonlaag. In vervolgconferenties werd deze uitfasering versneld, mede omdat in 1980 het gat in de ozonlaag werd ontdekt dat in de jaren daarna telkens groter bleek te worden. Uiteindelijk is een uitgebreide lijst van 95 ozonafbrekende stoffen opgesteld waarvan de productie wereldwijd wordt uitgefaseerd.
Invloed van stikstofmonoxide
Stikstofmonoxide, NO, kan eenzelfde rol spelen als de halogeenradicalen: NO is een stabiel molecuul, maar heeft ook een ongepaard elektron. (In het periodiek systeemw is te zien dat een stikstofatoom vijf valentie-elektronen heeft, terwijl een zuurstofatoom er 6 heeft. Dat leidt in NO dus tot een molecuul met 5 elektronenparen en één ongepaard elektron: een radicaal! Dat NO toch stabiel is volgt uit de quantumchemie.) De reacties zijn als volgt:
propagatie 1: NO + O3 → NO2 + O2
propagatie 2: NO2 + O• → NO + O2
In de stratosfeer kan NO worden gevormd uit distikstofoxide, N2O. In tegenstelling tot NO en NO2 kan N2O de stratosfeer bereiken waar het onder invloed van UV-straling via fotochemische reacties uiteen kan vallen in NO volgens de overall reactie:
2 N2O — hν→ 2 NO + N2
Stikstofmonoxide heeft ook nog een andere rol in de atmosfeer: de tijdens de ketenreactie gevormde NO2 kan ook met het ClO• uit de afbraakcyclus met chloor reageren tot ClONO2, chloornitraat. Een tweede reactie van NO2 is die met het hydroxylradicaal tot salpeterzuur (zie secundaire luchtverontreiniging). Beide stoffen kunnen uiteindelijk via hoge bewolking uitgewassen worden, waardoor ozonafbrekende stoffen uiteindelijk uit de atmosfeer worden verwijderd.
NO heeft dus twee effecten op de ozonlaag: enerzijds zorgt NO voor een extra mechanisme voor afbraak van ozon, anderzijds beperkt de aanwezigheid van NO de afbraakroutes van ozon die lopen via het hydroxyl- en het chlooroxideradicaal. Het netto-effect hangt af van de hoogte: boven de 25 km overheerst de afbraak, in het lagere gedeelte van de troposfeer overheerst de gunstige interferentie met de afbraakcyclus veroorzaakt door halogeenradicalen afkomstig van CFK's.
Zure regen
Regenwater is van nature licht zuur door de opname van CO2. Eenmaal opgelost in water stelt zich het carbonaat-evenwicht in:
CO2 + H2O ↔ H2CO3
H2CO3 + H2O ↔ H3O+ + HCO3-
HCO3- + H2O ↔ H3O+ + CO32-
Deze evenwichten samen zijn te schrijven als de evenwichtsvergelijking:
CO2 + H2O + CO32- ↔ 2 HCO3-
Uiteindelijk heeft regenwater door de aanwezigheid van CO2 in de atmosfeer een natuurlijke pH van 5,7.
De natuurlijke uitstoot van verzurende zwavelverbindingen en stikstofverbindingen leidt in principe óók tot (verdere) verzuring van het regenwater. Echter, de hoeveelheden die op natuurlijke wijze in de atmosfeer worden gebracht zijn te klein om in de praktijk van invloed te zijn op de pH van regenwater. Dat is anders voor de industriële uitstoot van verzurende emissies.
Zuurgraad
De zuurgraad van water is een bepalende eigenschap. Als de zuurgraad van regen hoger wordt en de pH daalt tot waarden onder de 5,5 spreken we van zure regen. De in de regen aanwezige zuren tasten gebouwen aan (verwering) en beïnvloeden de zuurgraad van bodems, wat ten koste kan gaan van de groei van (landbouw)gewassen en van bodemdieren. Belangrijke schimmels die organisch afval omzetten kunnen afsterven als de zuurgraad te hoog wordt.
Niet alleen in bodems, maar ook in oppervlaktewatersystemen bepaalt de pH primair of, en zo ja, welke, vormen van leven mogelijk zijn. In oppervlaktewatersystemen kan een te lage pH leiden tot verandering in algenpopulatie en zuurstofhuishouding: als de pH lager wordt dan 5 sterft (bijna) al het leven in zoetwatersystemen; uiteindelijk blijft er slechts een levenloos meer over, zoals bijvoorbeeld in de jaren '80 in Scandinavië is gebleken. Ook zorgt zure regen voor verzuring van de oceanen.
Ook bij de bereiding van voedsel is de pH belangrijk. Een pH lager dan 4 (azijn) werkt ontsmettend: schimmels, rotting en bederf krijgen zo geen kans. Voedsel zoals witte kool kan langer worden bewaard als het wordt behandeld met natuurlijke zuren (zuurkool). Vruchtenjam is lang houdbaar door enerzijds het hoge suikergehalte en anderzijds de zuurgraad.
Natuurlijke uitstoot zwavelverbindingen
Zwavel (S) is een veelvoorkomend element in de aardkorst en in zeewater. Het komt voor in de vorm van sulfides en sulfaten. Zinksulfide (ZnS) is bijvoorbeeld een belangrijk mineraal dat gewonnen wordt ten behoeve van de productie van zink (Zn). De meest voorkomende sulfaten zijn calciumsulfaat (CaSO4) en magnesiumsulfaat (MgSO4). Sulfaten spelen een belangrijke rol in de anaerobe afbraak van organisch materiaal (algemene verhoudingsformule CH2O) door bacteriën. In situaties waar geen zuurstof beschikbaar is en wel sulfaat, wordt het sulfaat gebruikt als bron voor zuurstof. De volgende anaerobe reactie treedt dan op:
1/2 SO42- + CH2O + H+ -> 1/2 H2S + H2O + CO2
Deze anaerobe afbraak via sulfaatreductie is een veeloptredende, natuurlijke afbraakroute van organisch materiaal op zeebodems doordat op zeebodems vaak (veel) organisch materiaal afzinkt en zeewater sulfaat bevat. In zoet water treedt deze reactie in veel natuurlijke wateren (moerassen) niet op doordat er geen sulfaat aanwezig is. Wereldwijd wordt via deze route ongeveer een kwart van de zwavel van biologische oorsprong naar de atmosfeer geëmitteerd. De andere route van natuurlijke, biologische zwavelemissie naar de atmosfeer is die door plankton in de oceanen. Als onderdeel van de stofwisseling emitteert plankton dimethylsulfide (DMS, H3C-S-CH3). In de atmosfeer worden zowel H2S als DMS geoxideerd tot SO2.
Zwavelcyclus
In de wereldwijde natuurlijke zwavelcyclus (zie onderstaande figuur) spelen de volgende fysieke processen een rol:
• emissie van sulfaten aanwezig in de aardkorst door stof
• emissie van sulfaten uit zeewater (vorming van microscopisch zeezout)
• natuurlijke verwering en erosie van de aardkorst
• emissie van H2S en andere zwavelverbindingen uit vulkanen
• depositie van hydrothermische sulfiden (vorming van sulfidische mineralen op de zeebodem uit vulkanen, geisers etc.)
• vorming van pyriet op/in de zeebodem
• depositie van sulfaten in zeezout (hoofdzakelijk in de oceanen)
• netto transport van land naar zee via de lucht
De emissie en depositie van sulfaten (stof, zeezout) is min of meer in balans: de door verwering en erosie ontstane sulfaten worden in de (diepe) oceaan langzaam weer omgezet in sulfides, sediment en uiteindelijk gesteenten. Sulfaten worden in de atmosfeer slechts beperkt omgezet. De natuurlijke emissie van zwavel is gekoppeld aan deze kringloop en in de loop van de tijd heeft zich een evenwicht ingesteld. De jaarlijkse hoeveelheid zwavel in dit gedeelte van de kringloop wordt geschat op 20 Mton.
De grootste invloed van de mens op de wereldwijde zwavelcyclus is de uitstoot van SO2 door verbranding van zwavelhoudende fossiele brandstoffen. Wereldwijd wordt de industriële uitstoot van zwavel geschat op zo'n 60 Mton, dus drie keer zo veel als de hoeveelheid zwavel in de biologische kringloop! Door de verbranding van fossiele brandstoffen en het winnen en verwerken van sulfidische ertsen wordt een reservoir (voorraad) van zwavel dat zich in miljoenen jaren heeft opgebouwd in korte tijd ontsloten. De zwavel komt in eerste instantie terecht in de atmosfeer en doordat, anders dan voor CO2, de atmosfeer voortdurend wordt ontdaan van zwavel, komt deze als zure regen in bijna alle watersystemen en bodems op aarde terecht.
De uitstoot van verzurende stoffen kan de biologische zwavelkringloop intensiveren doordat zure regen een bron van sulfaat is. Zure regen bevat immers zwavelzuur, H2SO4, waardoor in veel meer (water)bodems anaerobe afbraak van organisch materiaal kan (gaan) plaatsvinden.
Industriële uitstoot van zwavel- en stikstofverbindingen
Uitstoot van verzurende stoffen door elektriciteitscentrales en de industrie, met name NOx dat leidt tot HNO3, en SO2 dat leidt tot H2SO4, zorgt voor 'echt zure' regen, met een pH tot wel 4 of zelfs 3,5. Een dergelijke zuurgraad zorgt voor verwering en beschadiging van gebouwen en metaalconstructies, voor het verzuurd raken van bodems en onbruikbaar worden van landbouwgrond en het te gronde gaan van aquatische (eco)systemen door een veel te hoge zuurgraad van het water waarbij vele organismen niet (meer) kunnen overleven. In smog, in omstandigheden waarbij ook mist langdurig blijft hangen, kan de uitstoot van deze verzurende stoffen door centrales, industrie en verkeer de pH zelfs laten dalen tot 2,0 en is dan acuut schadelijk voor de gezondheid (Spiro and Stigliani (2003), p.279).
Vanaf de jaren '60 werden schoorstenen van centrales en fabrieken steeds hoger. Door ze door de eerste inversielaag in de atmosfeer heen te laten steken, worden de verzurende stoffen uitgeworpen in een luchtlaag waar veel horizontale stroming is, terwijl de gassen door temperatuurinversie niet naar beneden zakken. Het (gewenste) effect is dat de vervuiling vanaf een puntlozing over grote afstanden wordt verplaatst en verspreid voordat het als zure regen weer naar beneden komt. Het is dit mechanisme dat ervoor gezorgd heeft dat de meren in Scandinavië verzuurd zijn door uitstoot van Britse, Nederlandse en Duitse centrales en industrie.
Verwering
De aanwezigheid van CO2 in regenwater zorgt voor verwering van gesteente. In grote lijnen treden dan de volgende reacties met kalksteen, CaCO3, op:
CO2 + 2 H2O → HCO3- + H3O+
CaCO3 + 2 H+ → Ca2+ + H2O + CO2
De verwering van silicaten wordt beschreven door Spiro and Stigliani (2003), p.284:
Zand bestaat uit siliciumoxide, verhoudingsformule SiO2. De structuur van siliciumoxide is er één van een rooster van een oneindig 'netwerkpolymeer' waar elk siliciumatoom steeds verbonden is met vier zuurstofatomen en elk zuurstofatoom met twee siliciumatomen. Dit is een zeer stabiele structuur en zand is dan ook grotendeels chemisch inert. Echter, zand kan verweren door opname van andere elementen in haar rooster waardoor zgn. silicaten ontstaan. Veldspar (NaAlSi3O8) is zo'n silicaat en kan beschouwd worden als een 'mengsel' van de volgende componenten: Al2O3, SiO2 en Na2O. De verwering vindt plaats in twee stappen. Eerst reageert de Na2O met H2CO3 tot NaHCO3 (natriumbicarbonaat) en wordt SiO2 in gehydrateerde vorm (Si(OH)4), ook siliciumzuur genoemd, uitgestoten. De tweede stap is de langzame verwijdering van het gevormde bicarbonaat en siliciumzuur uit de veldspar, waarbij kaolien ontstaat. Dit is een van de bestanddelen van klei. Het geschetste mechanisme draagt dus bij aan de vorming van minerale bodems.
Voor beide bovengenoemde verweringsmechanismen geldt dat ze veel sneller gaan als het zwakke carbonzuur H2CO3 wordt vervangen door een sterk zuur zoals zwavelzuur (H2SO4) of salpeterzuur (HNO3). De verwering van silicaat-gesteente (CaSiO3) is onderdeel van de langzame koolstofkringloop.
Verzuring van de oceanen
De verzuring van de oceanen wordt door de WBGU (2006) uitgebreid beschreven in het rapport The Future Oceans - Warming Up, Rising High, Turning Sourw. De informatie op deze pagina is grotendeels gebaseerd op dit rapport.
Een consequentie van het feit dat regen van nature CO2 bevat in de vorm van (opgelost) waterstofbicarbonaat HCO3- is dat er met regen CO2 wordt gedeponeerd in de oceanen. Ook wordt CO2 opgenomen aan het oppervlak van de oceanen. Door stroming, wervelingen, wind en golven wordt uiteindelijk ook het diepere oceaanwater verrijkt met CO2. De oceanen bevatten ook basische stoffen, interacteren met bodem, ontvangen geërodeerd materiaal etc. Van nature stelt zich zo een evenwicht in, de pre-industriële pH van de oceanen bedroeg 8,18 en is dus licht basisch.
De zuurgraad van zeewater is afhankelijk van de CO2-concentratie, wat te zien is in onderstaande evenwichtsvergelijking. Een verhoogde atmosferische CO2-concentratie zorgt namelijk voor een verschuiving van het evenwicht richting het lichtzure waterstofbicarbonaat (HCO3-).
CO2 + H2O + CO32- ↔ 2 HCO3-
In de oceanen is het aandeel CO2 ca 1%, dat van HCO3- 91% en CO32- 8%. In onderstaande figuur is dit weergegeven. De pijl in de blauwe band geeft aan hoe de pH (en de concentraties in het carbonaatevenwicht) verandert als de atmosferische CO2-concentratie toeneemt naar 750 ppm (nu ca. 400 ppm).
Sinds het begin van de industriële revolutie is naar schatting de helft van de hoeveelheid CO2 uitgestoten door verbranding van fossiele brandstoffen, of een derde van de totale (verbranding plus verandering landgebruik) hoeveelheid uitgestoten CO2, in de oceanen opgenomen: tussen 1800 en 1995 een hoeveelheid van 118 ± 19 Gton koolstof. Dit heeft geleid tot een gemiddelde daling van de pH van de oceanen met 0,11, ofwel een toename van H+ met 30%.
De daling van de pH doet zich vooral voor aan het oppervlak van de oceanen en in de ondiepere gedeelten. Wetenschappers hebben vastgesteld dat het pH-signaal zich manifesteert tot ca. 1000 m diepte, in de Noord-Atlantische trog tot 3000 m diepte.
Een dalende pH is schadelijk voor het oceaanleven. In eerste instantie betreft dit koraalriffen: zij bouwen hun skelet op uit kalk. Als het water warmer en zuurder wordt gaat dit steeds moeilijker, doordat de hoeveelheid carbonaat (CO32-) in het zeewater afneemt. In 2009 is in Science een studie gepubliceerd naar de groei van koraalriffen in het Great Barrier Reef. Volgens de onderzoekers is deze sinds 1990 met 14% afgenomen (persbericht AIMSw).
Koraalriffen bouwen het calciumcarbonaat in aragoniet, een kalkmineraal met een iets andere kristalstructuur dan calciet, in. Als de carbonaatconcentratie in zeewater lager wordt dan 66 µmol/l dan is de vorming van aragoniet fysiologisch niet meer mogelijk en is het zeewater onderverzadigd voor de vorming van koraalriffen en kalkskeletten van schelpdieren. In de zuidelijke oceaan is het zeewater op sommige plaatsen al gevaarlijk arm aan carbonaat, nl. 105 µmol/l. Als de CO2-uitstoot niet vermindert, verwachten wetenschappers dat een groot deel van de zuidelijke oceanen de kritische grens voor schelpdier- en koraalgroei rond 2050 bereikt.
Hydrologische kringloop
Ongeveer 70% van het aardoppervlak is bedekt met water: oceanen, zeeën, meren en rivieren. Uit de wolken in de atmosfeer (zie hiervoor ook de foto van de aarde die gemaakt is door de bemanning van de Apollo 17) blijkt dat er op aarde een gigantisch verdampingsproces aan de gang is. Dit proces wordt aangedreven door de zon. De energie uit inkomende zonnestraling (gemiddeld over de aarde 240 W/m2) zorgt ervoor dat voortdurend grote hoeveelheden water uit de oceanen verdampen. In de atmosfeer vormen zich wolken, waaruit regen valt, maar door de heersende winden valt slechts een klein deel van die regen op land. Het is deze regen die uiteindelijk de bron is van al het zoete water op aarde. De kringloop van (zoet) water over de aarde wordt de hydrologische kringloop (cyclus) of grote waterkringloop genoemd. Deze kringloop kan worden onderverdeeld in drie subkringlopen.
De totale zoetwaterstroom in de grote waterkringloop is weliswaar erg groot, ca. 110.000 km3/jaar, maar is klein ten op zichte van de totale hoeveelheid water op aarde, ca. 1.386 miljoen km3. Zoals weergegeven in onderstaande figuur bevindt water zich in o.a. in zeeën en oceanen, in de ijskappen en gletsjers, in rivieren en zoetwaterbekkens, in grondwater (aquifers, bodem) en voor een relatief zeer klein deel in de atmosfeer.
Naast de hydrologische kringloop, de grote waterkringloop, bestaat er nog een andere waterkringloop, namelijk de kleine waterkringloop. Deze kleine waterkringloop is de (drink- en afval)waterketen.
Zuivering door de hydrologische kringloop
De hydrologische kringloop is niet alleen een kringloop, maar ook een zuiveringsproces. Immers, door verdamping en transpiratie (evapotranspiratie) komt in eerste instantie zuivere waterdamp in de atmosfeer terecht. In de atmosfeer neemt water (in de vorm van druppeltjes, wolken) allerlei stoffen op die aanwezig zijn in de atmosfeer. De bronnen van deze verontreinigende stoffen zijn niet alleen energievoorziening, huishoudens, transport en de industrie, want er zijn ook emissies met een natuurlijke oorzaak, zoals roetdeeltjes (bosbranden, vulkaanuitbarsting), stof (erosie, wind), SO2 (branden, vulkaanuitbarsting), NOx (bliksem), lachgas N2O (vegetatie natte gebieden), organische stoffen zoals terpenenw (naaldbossen) en methaan (anaerobe rotting).
In veel gebieden is de door mensen veroorzaakte uitstoot tegenwoordig vele malen groter dan de natuurlijke uitstoot. Dat is het geval voor verzurende stoffen, SO2 en NOx, maar ook voor roet (verbranding, steenkoolcentrales, verkeer), organische stoffen (methaan, organische oplosmiddelen, vervluchtiging van brandstoffen) en N2O (natte rijstlandbouw).Tijdens het zuiveringsproces in de atmosfeer vinden fotochemische reacties plaats en wordt primaire luchtverontreiniging omgezet door reacties waarin het hydroxylradicaal een cruciale rol speelt.
Watergebruik
Het water op aarde bestaat voor ca. 97% uit zout water, zeewater dat gemiddeld 24 g/l NaCl (keukenzout), bevat. Daarmee is het ongeschikt voor humane consumptie: mensen én dieren hebben zoet water nodig om niet uit te drogen, de mens gemiddeld 3 liter per dag. In onderstaande figuur is te zien dat zeewater ook andere zouten dan NaCl bevat. De mens gebruikt zoet water niet alleen om te drinken. Grote hoeveelheden zoet water worden gebruikt in de landbouw (irrigatie), de industrie (productie) en door huishoudens (persoonlijke hygiëne, wassen, toilet, tuin etc). Voor al dit watergebruik is voldoende water nodig (hoeveelheid - kwantiteit) dat van geschikte samenstelling (kwaliteit) is. Bij waterbeheer gaat het dus zowel om kwantiteits- als kwaliteitsbeheer.
Subkringlopen van de hydrologische kringloop
In onderstaande figuur is te zien dat er in de grote waterkringloop een aantal processen plaatsvindt waaronder verdamping, evapotranspiratie, neerslag, transport en runoff (afstromen) van water van hogere naar lagere gebieden en uiteindelijk naar de oceanen. In grote lijnen is de grote waterkringloop te beschouwen als een gesloten systeem voor water. Binnen de grote waterkringloop zijn drie subkringlopen of open subsystemen te herkennen:
• verdamping uit de oceanen, transport naar land, neerslag en runoff naar de oceanen
• verdamping uit de oceanen en neerslag in de oceanen
• verdamping en transpiratie op land (samen evapotranspiratie genoemd) en neerslag op land
De eerste subkringloop is ook meteen de kleinste qua volume: ca. 40.000 km3/jaar water verdampt uit de oceanen en komt als zoet water op land terecht. Het gaat hier om uitsluitend fysische processen. Vanuit systeemperspectief is deze subkringloop te zien als de resultante van de twee andere subkringlopen.
De verdamping uit de oceanen is groot, maar slechts ca. 10% van het water dat uit de oceanen verdampt valt als neerslag op landmassa's. De hoeveelheden verdelen zich ongeveer als volgt:
• verdamping: de verdamping uit de oceanen, φv,verdamping bedraagt naar schatting 425.000 km3/jaar
• neerslag land: naar schatting valt er wereldwijd op de landmassa's op aarde, φv,neerslag,land, 40.000 km3/jaar
• neerslag oceanen: deze waterstroom, φv,neerslag,oceanen, is dan (massabalans!) 385.000 km3/jaar
De tweede subkringloop is daarmee veel groter dan de eerste.
De derde subkringloop bestaat enerzijds uit rechtstreekse verdamping (evaporatie) en anderzijds uit transpiratie (actieve verdamping door planten). In deze subkringloop treedt dus ook een biologisch proces op. Het netto resultaat van deze subkringloop is in totaal een zoetwaterstroom van ca. 70.000 km3/jaar: water dat vanaf land wordt teruggebracht in de atmosfeer. Samen met de 40.000 km3/jaar water aangevoerd als waterdamp in de atmosfeer (uit de oceanen) valt er 110.000 km3/jaar als neerslag op land. De hoeveelheid water in de atmosfeer is relatief klein, ongeveer 13.000 km3.
De grote waterkringloop is vanzelfsprekend geen statisch systeem, maar een dynamisch systeem. De genoemde getallen zijn gemiddelden, schattingen van de gemiddelden gebaseerd op wat er wereldwijd is gemeten. Uit deze systeembeschrijving kan een aantal dingen opgemaakt worden:
• de gemiddelde verblijftijd, θ, van water in de atmosfeer is ongeveer een week: θ = 13.000 [km3] / (425.000 + 70.000 [km3/jaar]) · 365 [dagen/jaar] = 9,6 dagen
• de verdamping wordt aangedreven door zonnestraling, energie. Als de oceanen meer energie vasthouden (door de onbalans in de aardse stralingsbalans) dan zal de verdamping toenemen
• de evapotranspiratie op land wordt beïnvloed door temperatuur en vegetatie. Veranderend landgebruik heeft dus invloed op de grootte van de evapotranspiratie (minder vegetatie, bijv. minder tropisch regenwoud, betekent minder evapotranspiratie)
• de netto runoff en transport van waterdamp in de atmosfeer (oceanen naar land) bedraagt slechts ca. 10% van de verdamping uit de oceanen
• de runoff in de hydrologische cyclus wordt bepaald door de mate van verdamping én door het transport van wolken/waterdamp in de atmosfeer
• de grote waterkringloop is daarmee gevoelig voor veranderingen in heersende windrichtingen, wolkvorming etc.
Toepassing van de massabalans voor een specifieke regio, waarin géén aan- of afvoer van grond- en oppervlaktewater plaatsvindt, geeft de volgende vergelijking:
Δ(G+O) = (φv,neerslag - φv,evapotranspiratie) · τ
met:
G = hoeveelheid grondwater [m3]
O = hoeveelheid oppervlaktewater [m3]
φv = waterstroom [m3/s]
τ = beschouwde tijdvak [s]
Het is gebruikelijk om neerslag en evapotranspiratie uit te drukken als N [mm/dag], waarmee bovenstaande vergelijking verandert in:
Δ(G+O) = (Nneerslag - Nevapotranspiratie) · A · τ' / 1000 [mm/m]
met:
τ' = beschouwde tijdvak [dag]
A = oppervlak van het gebied [m2]
Als bekend is hoeveel vierkante meter oppervlaktewater er in een gebied is dan kan een eerste schatting uitgerekend worden van de stijging van dat oppervlaktewater na een periode van hevige neerslag. De vergelijking kan aangepast worden als bekend is dat er bijvoorbeeld een rivier door een gebied stroomt die water afvoert of dat er een gemaal is dat het water uitpompt, bijvoorbeeld:
Δ(G) = (φv,neerslag - φv,evapotranspiratie - φrivier of gemaal) · τ
In de hydrologische kringloop bestaan grote continentale en regionale verschillen.
Continentale en regionale verschillen in de hydrologische kringloop
Wanneer de hydrologische kringloop op het aggregatie- of systeemniveau aarde beschreven wordt, wordt voorbij gegaan aan de continentale en regionale verschillen die er zijn. Deze verschillen vinden hun oorsprong onder andere in locatie (geografische breedte, afstand tot de oceaan), aanwezigheid van hoge bergketens en de thermohaliene circulatie.
Geografische breedte
Wereldwijd zijn er verschillende klimaatzones te herkennen:
• tropen: van de evenaar tot de 10e breedtegraad. Deze zone wordt gekenmerkt door een zeer intensieve hydrologische kringloop. Er is veel zonnestraling en de passaatwinden brengen met regelmaat zware regens naar de tropische landmassa's, waar zich de afgelopen duizenden jaren grote regenwouden hebben gevormd. Deze regenwouden zorgen voor een grote plaatselijke evapotranspiratie, die nog eens bijdraagt aan de lokaal overvloedige en soms zeer intensieve neerslag.
• subtropen: ruwweg van de 10e tot de 23e breedtegraad (steenbok- en kreeftskeerkring). In het gebied van deze zone dat zich tegen de tropen aan bevindt, valt zeer weinig neerslag en liggen de grote woestijnen (Sahara, Gobi, Nevada woestijn, centraal Australië etc). Noordelijker resp. zuidelijker in de subtropische zone liggen gebieden met aangename temperaturen en redelijk veel neerslag. Onderliggende oorzaak is dat rond de evenaar lucht zo heet wordt dat deze tot grote hoogte stijgt waardoor er geen regen uit kan vallen in het gebied dicht tegen de tropen (daar waar dus de woestijnen liggen). Pas bij hogere breedtes zakt de lucht en kan er weer regen vallen.
• gematigde klimaatzones: van de 23e tot 57e breedtegraad. Op het noordelijk halfrond is dit de zone waarin zich Noord-Amerika (VS, zuidelijk deel Canada), Noordwest-Europa, Rusland en zuid/midden China bevinden. In deze zone zijn de corioliskrachtenw in de atmosfeer groot, waardoor de overheersende windrichting van west naar oost is. De verdamping uit de oceanen is in deze zone groot doordat er nog steeds veel zonnestraling is. In Noordwest-Europa is het weer wisselvallig doordat voortdurend wolkenvelden, depressies en hogedrukgebieden aangevoerd worden vanaf de Atlantische oceaan. In Noord-Amerika geldt hetzelfde (aanvoer vanaf de Grote Oceaan), terwijl het oostelijk deel van Rusland en China vaak droog zijn en Japan veel aanvoer heeft van de Chinese Zee. Op het zuidelijk halfrond bevindt zich hier de zuidelijke punt van Zuid-Amerika (Argentinië, Zuid-Brazilië), zuidelijk Afrika (van Kenia, Tanzania naar Zuid-Afrika) en een deel van Australië.
• subarctische zone: van de 57e breedtegraad tot de poolcirkel (66,5e breedtegraad). In dit gebied wordt het klimaat gekenmerkt door eigenlijk maar twee seizoenen, zomer en winter, en een heel korte lente resp. herfst. Het weer is hier minder wisselvallig: de afwisseling van hoge- en lagedrukgebieden is minder of afwezig. De plantengroei is langzaam door de geringe zonnestraling. De hydrologische kringloop is relatief mild met beperkte hoeveelheden neerslag. In deze zone bevinden zich de uitgestrekte toendragebieden van Canada en Siberië. Het uiterste zuiden van Zuid-Amerika en het noorden van Antarctica liggen ook in deze klimaatzone. Hier vindt wel een groot deel van de wereldwijde neerslag en runoff plaats doordat het om zeer grote gebieden gaat.
• arctisch: boven (of beneden) de poolcirkel. Op het noordelijk halfrond zijn Groenland en de noordelijke ijszee bedekt met land- respectievelijk zeeijs. Op het zuidelijk halfrond bevindt zich de (tot 3 kilometer dikke) ijskap van Antarctica. Rond de poolcirkel komt vooral veel leven voor in de ijszee; op het zuidelijk halfrond is dit bijvoorbeeld het gebied waar krill, een garnalensoort, groeit. Krill is het voedsel van een aantal baleinwalvissen (o.a. de blauwe en grijze vinvis). In dit gebied is de hydrologische kringloop nog langzamer dan in de subarctische zone.
Regionale klimaatvariatie
Binnen elk van bovenstaande klimaatzones zijn er ook weer grote regionale verschillen, die in hoofdzaak veroorzaakt worden door de aanwezigheid en ligging van (hoge) bergketens en de grootte van de landmassa's. In de gematigde klimaatzone van Noord- en Zuid-Amerika fungeren bijvoorbeeld de Rocky Mountains resp. de zuidelijke Andes als een barrière voor neerslag: de wolken van de Grote Oceaan regenen uit tegen of in deze bergketens. Verder naar het oosten liggen dan grote vlaktes, de Great Plains in Amerika en de pampa's van Argentinië, waar jaarlijks nog maar weinig neerslag valt. Op lagere breedtes, met name in Zuid-Amerika, is te zien dat ten oosten van de Andes, de bergketen waar de Amazone ontspringt, juist een enorm regenwoud is ontstaan met een zeer intensieve plaatselijke hydrologische kringloop.
In Noordwest-Europa kunnen de weersystemen vanuit de Atlantische oceaan ongehinderd door bergketens ver Europa indringen. Vanzelfsprekend regent het dichter bij de Atlantische kust gemiddeld meer, maar heel Noordwest-Europa kent een behoorlijke jaarlijkse neerslag. Gecombineerd met een vruchtbare bodem is dit dan ook al eeuwen een zeer productief landbouwgebied, iets wat eveneens geldt voor de noordelijke helft van de VS (de Mid-West), Wit-Rusland en de Oekraïne. Op het zuidelijk halfrond is er een vergelijkbaar patroon met grote vruchtbare landbouwgebieden in Afrika (Zuid-Afrika, Zaïre etc.), Australië en Zuid-Amerika.
Thermohaliene circulatie
Oceanografen doen veel onderzoek naar het wereldwijde systeem van thermohaliene circulatie: oceaanstromingen (circulatie in de oceanen) door dichtheidsverschillen als gevolg van verschillen in temperatuur en zoutconcentratie. Daarnaast bestaat er windgedreven circulatie: stromingen in de oceanen veroorzaakt door wind, wat met name speelt aan het oppervlak. In onderstaande figuur zijn met rode lijnen de oppervlaktestromen en met blauwe lijnen de diepzeestromen aangegeven.
Een voor Noordwest-Europa uiterst belangrijk deel van dit systeem is de warme golfstroom, die een onderdeel is van een thermohaliene circulatie in de Atlantische oceaan. In de noordelijke IJszee bij Groenland zinkt koud geworden zeewater naar grotere dieptes en stroomt naar de kust van Noord-Amerika. Het water wordt opgewarmd in de oceaan, ten noorden van het Caribisch gebied, en stroomt aan de oppervlakte als warme golfstroom naar de andere kant van de Atlantische oceaan. Een groot deel van deze stroom gaat langs Noord-Frankrijk en Zuid-Engeland door het Kanaal en heeft invloed tot in Scandinavië. De getransporteerde hoeveelheid warmte is zo groot dat de gemiddelde temperatuur in Noordwest-Europa ca. 6 tot 10 °C hoger is dan zonder deze warme golfstroom. Boven Scandinavië arriveert het inmiddels afgekoelde water weer in de Noordelijke ijszee en begint aan een nieuwe kringloop.
De thermohaliene circulatiestromen zorgen voor enorme transporten van energie in de vorm van warmte. De hoeveelheid energie in de warme golfstroom wordt bijvoorbeeld geschat op 1,3 PW (Steele et al. (2009)). Thermohaliene circulatie heeft daarmee een grote invloed op de mate van verdamping en de neerslagpatronen op aarde. Door de warme golfstroom is het bijvoorbeeld niet alleen warmer in Noordwest-Europa, maar ook natter.
Naast het hoofdsysteem dat in de figuur weergegeven is, zijn er meerdere lokale circulatiestromen. Zo is er (geografisch gezien) onder de evenaar in de Grote Oceaan een circulaire oceaanstroming. Deze gaat van Noord-Peru over de oceaan naar Noordoost-Australië, langs Australië en naar het noorden van Antarctica, vanwaar het water langs de kust van Zuid-Amerika (Chili) naar Noord-Peru, Ecuador en Colombia stroomt. Aan de kust van Zuid-Amerika (Chili) komt deze voedselrijke, relatief koele Humboldtstroomw aan de oppervlakte en voedt daarmee het Humboldt Large Marine Ecosystem. Door de combinatie van voortdurende aanvoer en verversing van voedingsstoffen en de grote hoeveelheid zonnestraling is er nergens een hogere biomassaproductie dan hier (er wordt meer dan 300 g/m2/jaar aan koolstof vastgelegd). De Humboldtstroom kan worden verstoord door een langdurige El Niño. In dat geval wordt het voedselrijke Humboldt-water teruggedrongen door voedselarm, opgewarmd water uit tropische gebieden met als vanzelfsprekend gevolg een keldering van de aantallen sardines, ansjovis en makreel.
El Niño en La Niña
Colombia, Ecuador, Peru en Australië hebben te maken met een fenomeen dat in de Engelse vakliteratuur bekend staat als de El Niño/La Niña Southern Oscillation (ENSO)w. Dit is een oscillatie in het wereldwijde atmosferische systeem die begint met een verstoring van de passaatwinden en als gevolg heeft dat de neerslagpatronen en temperatuur in de tropen tijdelijk veranderen. De oscillaties duren 1 tot soms wel 2 jaar.
Naast perioden dat de situatie normaal is, ontstaan dus afwisselend El Niño en La Niña. De eerste staat daarbij voor (meestal een jaar van) extreem veel neerslag in Zuid-Amerika, met overstromingen in Noord-Peru en Ecuador tot gevolg, en droogte in Australië. Bij La Niña gaat de slinger precies de andere kant op en is het extreem droog in Zuid-Amerika, terwijl er overstromingen in Australiëw kunnen zijn (zoals in 2010 het geval was).
Door de eeuwen heen lijkt het erop dat El Niño en La Niña gemiddeld eens in de 5 tot 7 jaar optreden. Er zijn echter ook decennia bekend met drie El Niño's of La Niña's. Deze ENSO heeft vanaf de prehistorie geleid tot hongersnood en zelfs teloorgang van beschavingen aan de kusten van Zuid-Amerika. In Australië is tot de moderne tijd geen landbouwsamenleving tot ontwikkeling gekomen.
Beschikbaarheid van zoet water
De hoeveelheid neerslag en de variatie daarin door de jaren en seizoenen heen kan sterk verschillen. Daarnaast kan uit de wereldwijde grote waterkringloop worden opgemaakt dat zoet water betrokken moet worden uit een systeem waarin jaarlijks zo'n 40.000 km3 circuleert van oceanen naar land en weer terug. Is deze gigantische hoeveelheid voldoende om te voorzien in de behoefte aan zoet water?
De runoff is niet gelijkmatig in de tijd. Overvloedige neerslag, of het smeltwater uit berggebieden in het voorjaar, moet simpelweg snel naar zee afgevoerd worden om overstromingen te voorkomen. Slechts een gedeelte blijft voor langere tijd beschikbaar in natuurlijke zoetwaterbekkens (brede rivierbeddingen in delta's en meren) of is aanwezig (stroomt voorbij) juist als het nodig is. De mens houdt ook een klein gedeelte vast in kunstmatige zoetwaterbekkens, waarmee de beschikbaarheid van zoet water voor drogere jaargetijden zekerder wordt gesteld. Overal ter wereld hebben mensen dit soort systemen ontwikkeld. In Spanje zijn bijvoorbeeld veel stuwdammen aangelegd om zo in de achterliggende rivierdalen stuwmeren te creëren. Daarnaast zijn waterkrachtcentrales opgenomen in de dammen. Met deze zoetwaterbekkens kan Spanje de doorgaans zeer droge en hete zomers overbruggen. Wereldwijd is het effect van stuwdammen op runoff substantieel. In Nederland fungeren het IJsselmeer en de afgesloten zeearmen in het deltagebied van Zuid-Holland en Zeeland als zoetwaterspaarbekken. Met name de land- en tuinbouw moet in het voorjaar en de zomer altijd de beschikking hebben over voldoende zoet water. De spaarbekkens dienen voldoende water te bevatten om (langdurige) periodes zonder neerslag te kunnen overbruggen, zodat begieten (tuinbouw) en irrigatie (landbouw) mogelijk is en de gewassen niet verloren gaan.
De stabiele runoff wordt weliswaar overal ter wereld gevonden (de grootte van de runoff-stromen is afhankelijk van de klimaatzone en lokale fysisch-geografische kenmerken), maar ca. een derde van de wereldwijde stabiele runoff loopt door onbewoonde gebieden. De totale hoeveelheid stabiele runoff door bewoonde gebieden bedroeg in 2000 ca. 9.500 km3 (McKinney et al. (2007)).
Ten slotte is een deel van dit water (te) sterk vervuild om gebruikt te kunnen worden. Er kunnen twee typen vervuiling worden onderscheiden:
• chemische watervervuiling door lozing van industrieel afvalwater. Onder meer de pulp & paper-industrie heeft in de eerste driekwart van de 20e eeuw een slechte reputatie opgebouwd; voor de productie van papier maakte men in die tijd op grote schaal gebruik van chloorhoudende chemicaliën en de restproducten werden ongezuiverd geloosd met het vele water dat deze fabrieken gebruikten. Langs de Rijn, de grootste rivier van Europa, hebben de Franse kalimijnen, de Zwitserse farmaceutische industrie en de Duitse chemische industrie in dezelfde tijd een slechte naam opgebouwd. Overal ter wereld veroorzaakten grote en kleine metaalbedrijven, leerlooierijen etc. waterverontreining met looistoffen, zuren en giftige metalen. In veel industrielanden keerde vanaf eind jaren '70 echter het tij en werd mede onder druk van de bevolking strengere milieu- en waterwetgeving ontwikkeld waarmee de lozingen aan banden werden gelegd. De genoemde industrieën ontwikkelden veelal nieuwe, schonere processen.
• biologische watervervuiling door lozing van rioolwater. Op veel plaatsen in de wereld hebben (wereld)steden (nog) geen rioolwaterzuiveringsinstallaties of beschikken ze slechts over installaties met beperkt zuiveringsrendement waardoor rivier- en zeewater vervuild wordt. Als de belasting de natuurlijke draagkracht (carrying capacity) te boven gaat, raakt het watersysteem blijvend vervuild doordat het ecosysteem te gronde gaat en natuurlijke zuivering niet meer plaatsvindt.
Grondwater
Wereldwijd is grondwater meestal schoon en overal aanwezig. Juist onder droge gebieden zonder rivieren en meren, en zelfs in woestijnen, wordt vaak water op enkele meters tot tientallen meters onder het aardoppervlak gevonden. Recent zijn grote hoeveelheden water onder de Sahara ontdekt. Grondwater bevindt zich in aquifers: herkenbare watervoerende lagen in de bodem waar grondwater als het ware (langzaam) doorheen stroomt, zie onderstaande figuur. De watervoerende laag is doorlaatbaar gesteente, of een pakket van zand, grind en dergelijke waar water langzaam doorheen kan stromen. Deze laag kan zijn begrensd c.q. afgesloten door een geheel ondoordringbare of semi-doordringbare laag. Vanuit het oppervlak wordt de aquifer aangevuld doordat een deel van de neerslag niet als runoff over land naar zee wordt afgevoerd, maar de bodem intrekt en daar zijn weg naar de aquifer vindt.
Aquifers kunnen erg groot zijn: de Ogallala Aquiferw of High Plains Aquifer in de VS bestrijkt een oppervlak van 450.000 km2. Ongeveer 27% van al het geïrrigeerde land in de VS ligt boven deze aquifer, die ongeveer 30% van het grondwatergebruik voor irrigatie in de VS levert. Ruim 80% van de mensen in het gebied is voor drinkwater afhankelijk van deze aquifer. De Great Artesian Basinw is een van de grootste ondergrondse waterreservoirs. De Aboriginals gebruikten de natuurlijke bronnen en vanaf 1891 zijn er (op steeds grotere schaal) putten geslagen om het water naar boven te halen. Samen met de vruchtbare bodem is het water de belangrijkste reden dat het oosten van Australië een zeer productief landbouwgebied heeft kunnen worden.
Het water in aquifers is zeer oud, duizenden tot miljoenen jaren, en wordt slechts (zeer) langzaam aangevuld, m.a.w.: de zgn. recharge is klein, iets wat duurzame exploitatie (duurzaam watergebruik) moeilijk maakt. Wereldwijd is het gebruik van grondwater uit aquifers de laatse decennia explosief gestegen. De genoemende aquifers in de VS en Australië vertonen alle tekenen van overexploitatie. In een aantal gevallen, o.a. in de Verenigde Staten, wordt deze situatie nog verergerd doordat de aquifer niet meer zo snel wordt aangevuld als tientallen tot duizenden jaren geleden: de Ogallala aquifer wordt in het noorden gevuld door neerslag, maar juist die neerslag is minder geworden terwijl de irrigatie zijn tol heeft geëist.
Waterketen
De waterketen, de kleine waterkringloop, is het systeem dat bestaat uit drinkwatervoorziening en afvalwaterzuivering, van het punt van onttrekking aan de grote waterkringloop (hydrologische kringloop) tot het moment van teruggave aan diezelfde grote waterkringloop.
Een groot deel van het water dat onttrokken wordt aan de natuurlijke (grote) waterkringloop wordt gebruikt voor irrigatie in de landbouw. Een ander deel wordt gebruikt in de industrie, enerzijds als koelwater voor elektriciteitscentrales, anderzijds als proceswater: water dat gebruikt wordt als medium voor het proces, of dat daadwerkelijk in het product terecht komt. Het laatste grote aandeel is het drinkwatergebruik van huishoudens en bedrijven.
In de waterketen kunnen twee hoofdfuncties onderscheiden worden:
1) water onttrekken en indien nodig geschikt maken voor gebruik
2) water na gebruik inzamelen en eventueel zuiveren voor verantwoorde teruggave aan de grote waterkringloop.
De waterketen kan dus beschouwd worden als een totaalsysteem waarin twee subsystemen zijn te herkennen:
1) drinkwater
• onttrekking van oppervlaktewater of grondwater: spaarbekkens, productieputten, inlaatvoorzieningen
• productie (zuivering): zuiveringsinstallaties (waterfabriek)
• transport en distributie naar huishoudens en bedrijven: pompstations, leidingen (infrastructuur)
2) afvalwater (en hemelwater neergekomen op verhard oppervlak)
• inzameling stedelijk gebied + bedrijven: riolering (leidingen, rioolkelders, overstort)
• transport naar zuivering: rioolpersleidingen
• zuivering: afvalwaterzuivering (awzi) of rioolwaterzuivering (rwzi)
• lozing effluent (groot oppervlaktewater of Noordzee): effluentleidingen
Het gehele systeem waarbinnen de mens gebruik maakt van water is groter dan alleen de waterketen, er is/zijn namelijk ook:
• grote industrieën die een eigen watervoorziening en industriële afvalwaterzuivering hebben
• land- en tuinbouw die zorgt voor de onttrekking van grond- en oppervlaktewater
• elektriciteitscentrales die netto grond- of oppervlaktewater onttrekken voor koeling
Watergebruik
Wereldwijd leidt watergebruik tot problemen: er zijn grote gebieden die te kampen hebben met droogte en watertekort en op veel plaatsen is watervervuiling een ernstig, acuut probleem.
Er kunnen verschillende vormen van watergebruik (en -teruggave) onderscheiden worden:
1) onttrekken zonder impact
• kwantiteit: gebruik en retour naar hydrologische kringloop
• kwaliteit: bij retour grotendeels hetzelfde
• voorbeeld: koelwater, kleinschalig gebruik rivierwater
• kenmerk: natuurlijke functies van het deel van de waterkringloop waarop is aangesloten blijven grotendeels onaangetast
2) onttrekken met impact
• kwantiteit: gebruik en retour naar hydrologische kringloop
• kwaliteit: bij retour (sterk) verslechterd
• voorbeeld: proceswater van een papierfabriek, watergebruik van een (middel)grote stad
• impact: zowel door onttrekking als teruggave (lozing) komen de functies van het deel van de waterkringloop waarop is aangesloten onder druk te staan
3) (finale) consumptie
• kwantiteit: onttrekking aan hydrologische kringloop, géén of slechts klein deel retour naar de lokale/regionale kringloop
• kwaliteit: als er een gedeelte retour gaat dan is de kwaliteit meestal slecht
• voorbeelden van kleine vervuilde retourstromen: watergebruik kalimijnen in Frankrijk, brijn afkomstig van de glastuinbouw (bij het ontzouten van grondwater met omgekeerde osmose ontstaat een zouter concentraat genaamd 'brijn')
• voorbeelden zonder retour: grond- of oppervlaktewateronttrekking voor irrigatie, gebruik van aquifers in Australië, het verdwijnen van het Aralmeer in Rusland
• impact: natuurlijke functies van water(systemen) kunnen niet (meer) vervuld worden, landbouw en visserij stopt door verdroging, verlaging grondwater, het natuurlijk gevormde systeem verdwijnt of gaat te gronde
De eerste situatie is er een van een kleine gemeenschap die gebruik maakt van natuurlijke hulpbronnen op zodanige schaal en manier dat er geen grote, blijvende of onherstelbare schade ontstaat aan het systeem van waaruit wordt geput.
De tweede situatie is kenmerkend voor economieën met snelle (industriële) ontwikkeling en/of bevolkingsgroei. De onttrekking van water wordt steeds groter, terwijl de effecten van grootschalige onttrekkingen vaak langzaam en later zichtbaar en merkbaar worden. De lozing van afvalwater is eerst lokaal, maar neemt geleidelijk steeds grotere vormen aan. De overlast en gezondheidseffecten van watervervuiling worden eerst voor lief genomen, maar raken steeds meer mensen. De belangen van vervuilers, gebruikers van water, bewoners, werknemers en eigenaars lopen heel vaak uiteen. Het kan gaan om verschillende gemeenschappen aan de loop van een rivier en/of om industriële bedrijven waar de eigenaars, werknemers of aandeelhouders elders wonen en leven. Veelal manifesteren problemen zich in volle hevigheid terwijl wet- en regelgeving en concurrerende technologie nog moet worden ontwikkeld. Na de Tweede Wereldoorlog is in Europa, de Verenigde Staten en Japan veel industrie snel tot ontwikkeling gekomen en zijn steden snel gegroeid. Vanaf de jaren '80 is er veel technologie en wetgeving ontwikkeld om de vervuiling sterk te verminderen en verstoorde watersystemen te revitaliseren. De rivier de Theems is daarvan een goed voorbeeld. In Nederland zijn overal geavanceerde rioolwaterzuiveringsinstallaties geplaatst, industriële afvalwaterzuiveringsinstallaties gebouwd en zijn diverse industriesectoren ingrijpend gesaneerd. Overigens herhaalt de geschetste ontwikkeling zich in de BRIC-landen (Brazilië, Rusland, India, China) en andere landen met sterke economische groei: eerst ongebreidelde ontwikkeling, daarna end-of-pipe en schoonmaken, en ten slotte echt schone technologie en systemen gebruiken.
De derde situatie beschrijft in een notendop de uitdaging in deze 21e eeuw. Een van de centrale thema's op het 2-jaarlijkse Wereld Water Forum is of we afstevenen op een wereldwijde watercrisis en hoe deze af te wenden. Door de sterke groei van de bevolking en welvaart ontstaat op veel plaatsen in de wereld waterschaarste. Grondwatervoorraden (o.a. in aquifers) die decennia zijn gebruikt, hebben her en der het probleem gemaskeerd, dan wel de noodzaak verkleind om op korte termijn aan oplossingen te werken. Andere watersystemen zijn sterk vervuild geraakt, terwijl overal ter wereld de vraag naar zoet water toeneemt, met name voor de land- en tuinbouw, maar ook voor de industrie en de bevolking.
De afgelopen jaren is er steeds meer aandacht gekomen voor duurzaam watergebruik.
Gebruik zoet water
Naar schatting bedroeg het wereldwatergebruik in 2000 zo'n 4.000 km3 (GRID Arendalw). Er is maximaal ongeveer 9.500 km3 aan zoet water beschikbaar, maar daarvan is ongeveer 3.500 km3 te vervuild voor gebruik (McKinney et al. (2007)). Volgens onderstaande figuur neemt het watergebruik exponentieel toe. De bevolking neemt toe, de welvaart neemt toe, en de watertechnologie biedt blijkbaar niet voldoende soelaas. Uit het voorgaande is op te maken dat er afgestevend wordt op een wereldwijd watertekort. Veel experts waarschuwen zelfs voor een wereldwijde watercrisis. Achter deze geaggregeerde getallen gaat vanzelfsprekend een wereld van verschil schuil: er zijn gebieden met meer dan voldoende water en er zijn gebieden waar al eeuwen een tekort is en waar men geleerd heeft spaarzaam te zijn.
Het is lastig om de ontwikkelingen een stap dieper dan toenemende bevolking en welvaart te duiden, daarom worden hieronder ontwikkelingen genoemd die een rol spelen:
• industriële ontwikkeling: deze heeft niet alleen geleid tot een vraag naar water vanuit de industrie, ze heeft ook stedelijke ontwikkeling in bijvoorbeeld de woestijn mogelijk gemaakt. Lima, de hoofdstad van Peru, is daar een voorbeeld van. Deze stad met inmiddels meer dan 11 miljoen inwoners is afhankelijk van drinkwaterleidingen die aansluiten op bronnen hoog in de Andes, tientallen kilometers van de stad. Tienduizenden veelal arme inwoners zijn aangewezen op waterverkopers met tankwagens doordat de ontwikkeling (en het eigendom) van deze leidinggebonden infrastructuur de ontwikkeling van de stad niet heeft kunnen bijhouden. Recentelijk zijn midden in de woestijn in Saudi-Arabië grote steden bijna uit het niets verrezen. In Phoenix, Arizona hebben veel huizen een gazon en zwembad, midden in de woestijn.
• landbouw: de relatie tussen aantal mensen, voedsel en daarmee water is evident. Of mensen nu in de woestijn wonen of in gebieden met meer overvloedig drinkwater, een grotere bevolking betekent eveneens meer en/of intensievere landbouw en dat betekent netto een hoger watergebruik. De hoeveelheid water voor voedsel per mens neemt wellicht toe doordat het menu bij toenemende welvaart meer water vraagt.
• markten en de mogelijkheden voor transport van bederfelijke waar: deze hebben wereldwijd geleid tot verandering in de gewassen die boeren telen. In veel gevallen heeft dit geleid tot een toename in watergebruik. Katoen is in dit geval exemplarisch aangezien dit een gewas is dat veel water vraagt en in monoculturen wordt verbouwd waar veel landbouwchemicaliën worden gebruikt, waardoor watervervuiling ontstaat in veel (sub)tropische gebieden waar katoen wordt verbouwd voor de wereldmarkt. In Nederland heeft de mechanisatie van de landbouw gezorgd voor een verandering van de waterhuishouding: met name door de noodzakelijke verlaging van de grondwaterstand is de netto runoff toegenomen.
Duurzaam watergebruik
De afgelopen jaren is er steeds meer aandacht gekomen voor duurzaam watergebruik. Duurzaamheid (duurzame ontwikkeling) is volgens de definitie van de Commissie Brundtlandt:
''voorzien in onze behoefte zonder dat dat ten koste gaat van de mogelijkheid voor toekomstige generaties om in hun behoeften te voorzien" (WCED (1987)).
Vertaald naar wateronttrekking, watergebruik en de lozing van afvalwater betekent dit dat:
• oppervlaktewater de voorkeur heeft bij onttrekking
• voor het gebruik van water ingezet moet worden op waterbesparing, efficiënt en effectief irrigeren en produceren
• lozing alleen kan en mag na zuivering, en wel zo dat het ontvangende watersysteem zijn functies kan blijven vervullen
Oppervlaktewater (rivieren, meren, beekjes) wordt immers voordurend ververst in de grote waterkringloop, terwijl grondwater slechts zeer langzaam wordt aangevuld. Voor afvalwater geldt dat reiniging in natuurlijke systemen alleen kan volstaan als de hoeveelheid afvalwater beperkt is. Grotere hoeveelheden (steden, fabrieken) vragen om industriële afvalwaterzuivering.
Volgens de WCED (1987) kent duurzame ontwikkeling drie hoofdkenmerken:
• “sustainability”: zodanig gebruik van (natuurlijke) hulpbronnen dat kan worden voorzien in de behoefte van huidige en toekomstige generaties
• “equity”: zodanige ontwikkeling van de mondiale economie en samenleving dat in ieders behoefte kan worden voorzien
• “diversity”: zodanige ontwikkeling dat culturele diversiteit en biodiversiteit behouden blijft
Het gebruik van grondwater zou eigenlijk moeten voldoen aan deze drie kenmerken van duurzame ontwikkeling. Het eerste kenmerk vertaalt zich dan in een criterium dat aan een aquifer nooit meer mag worden onttrokken dan de recharge. Immers, een eenvoudige massabalans laat zien dat in het andere geval de aquifer uiteindelijk onherroepelijk zal worden uitgeput. Het tweede kenmerk vertaalt zich in dusdanig beheer dat eenieder een gelijkwaardig deel krijgt van het beschikbare water, terwijl het systeem als geheel niet te gronde gaat; de aquifer is te zien als een common pool resource die adequaat beheerd moet worden. Het derde kenmerk vertaalt zich tenslotte in dat het water niet uitsluitend voor één doel gebruikt zou moeten worden, maar sociale en biodiversiteit zou moeten bevorderen en in stand zou moeten houden.
Klimaatsysteem
De systeembenadering kan gebruikt worden om het klimaatsysteem, het broeikaseffect en het versterkte broeikaseffect te beschrijven en te verklaren, onder andere door hierbij een energiebalans van de aarde op te stellen.
De afgelopen decennia is er in toenemende mate bezorgdheid ontstaan over de stabiliteit van ons klimaat. Wereldwijd smelten gletsjers, de hoeveelheid zeeijs op de Noordpool neemt af, de ijskap van de Kilimanjaro smelt weg, etc. Deze effecten zijn in verband gebracht met de toename van de CO2-concentratie in de atmosfeer door de verbranding van fossiele grondstoffen. Met name de uitstoot van het broeikasgas CO2 krijgt in deze discussie veel aandacht, maar ook de verandering van landgebruik speelt een rol, met name ontbossing ten behoeve van vergroting van het landbouwareaal.
Het Intergovernmental Panel on Climate Change (IPCC)w is in 1988 opgericht om wereldwijd wetenschappers bij elkaar te brengen, de kennis over het klimaat bij elkaar te brengen en te komen tot een zo goed mogelijk onderbouwde 'assessment' van de toestand van het klimaat en de voorspelling van klimaatveranderingen. In haar vijfde assessment reportw (IPCC (2014)) stelt het IPCC dat het extremely likely is dat de waargenomen opwarming van de aarde sinds halverwege de 20e eeuw het gevolg is van menselijk handelen. In maart 2023 is het zesde assessment reportw verschenen, met daarbij een overzicht met antwoorden op veelgestelde vragenw zoals: "Wat is het bewijs voor klimaatverandering?" en "Hoe weten we dat mensen klimaatverandering veroorzaken?"
De stand van de wetenschappelijk onderbouwde kennis over de mogelijke effecten van de toename van broeikasgassen in de atmosfeer samen met de andere effecten die de energiebalans van de aarde verstoren heeft geleid tot de zogenaamde '2-graden grens'. Boven deze grens zal de mensheid te maken krijgen met extreme klimaatveranderingen. In haar vijfde assessment report schrijft het IPCC dat het volgens de modelresultaten voor meer dan 66% zeker is dat de cumulatieve menselijke uitstoot van CO2-emissies sinds 1870 beneden ca. 2900 Gton moet blijven om de door menselijke invloeden veroorzaakte temperatuurverhoging ten opzichte van de periode 1861-1880 minder dan 2 °C te laten zijn en dat daarvan in 2011 reeds ca. 1900 Gton was uitgestoten. Tijdens het klimaatakkoord van Parijs (2015)w is door de landen afgesproken te streven naar een maximale temperatuurstijging van 1,5 °C. Het IPCC heeft een speciaal rapport (SR1.5)w geschreven over deze temperatuurstijging met bijbehorende scenario's voor de uitstoot van broeikasgassen.
Met de komst van krachtige computers en het werk van klimaatwetenschappers zijn vanaf de jaren '70 grote modellen ontwikkeld die bedoeld zijn om het klimaat te beschrijven en te komen tot een voorspelling van de gevolgen van de uitstoot van broeikasgassen, verandering van landgebruik, stof in de atmosfeer etc.
Klimaatmodellen
In de klimaatmodellen ('Global Circulation Models' of GCM-modellen) die gebruikt worden om het klimaat te beschrijven en te komen tot voorspellingen met betrekking tot de gevolgen van de uitstoot van broeikasgassen etc, zijn in de loop der tijd steeds meer bronnen en vastleggingsmogelijkheden van broeikasgassen meegenomen. Ook zijn diverse mee- en tegenkoppelingen geïmplementeerd.
Een voorbeeld van een meekoppeling, met een potentieel destabiliserend effect op het klimaat, is de mate van verdamping van water. Als de energiebalans van de aarde verstoord raakt en er netto accumulatie van energie in het systeem aarde optreedt, zal een groot deel van deze energie in de wereldzeeën terechtkomen. Daardoor neemt de temperatuur van het zeewater enigzins toe, maar belangrijker, ook de snelheid van verdamping en de evenwichtsconcentratie van water in de atmosfeer. Doordat water in de atmosfeer net als CO2 een sterke broeikaswerking heeft, ontstaat zo een zichzelf versterkend effect: meer water in de atmosfeer leidt tot vasthouden van nog meer energie, wat leidt tot nog meer opname in de oceanen en meer verdamping. De invloed op het versterkt broeikaseffect is echter zeer beperkt.
Een voorbeeld van een stabiliserende tegenkoppeling is de aanwezigheid van stofdeeltjes in de atmosfeer. Zelfs door een kleine toename van de temperatuur kunnen gebieden op aarde verwoestijnen en net als bij een vulkaanuitbarsting zal daardoor gemiddeld meer stof in de atmosfeer komen. Stof heeft gemiddeld een afkoelend effect doordat het netto zonlicht reflecteert. Hier is dus sprake van een stabiliserende tegenkoppeling in het klimaatsysteem. De uitbarsting (in 2002) van de vulkaan Pinatubo heeft een grote hoeveelheid stof in de hogere lagen van de atmosfeer gebracht. Het effect daarvan op de mondiale gemiddelde temperatuur kwam goed overeen met de voorspellingen in klimaatmodellen: met de gegevens van deze uitbarsting konden de modellen op dit punt worden gecalibreerd.
In de loop der tijd zijn de klimaatmodellen niet alleen completer geworden, maar ook steeds groter en gedetailleerder. Wetenschappers proberen op een steeds hogere resolutie voorspellingen te doen over het klimaat: van wereld naar continenten en soms zelfs landen, van voorspellingen over smeltende poolkappen naar de zeespiegelstijging in de Noordzee.
Wat blijft, is dat klimaatmodellen het klimaat voorspellen, NIET het weer van morgen, volgende week of volgend jaar. Het klimaat veroorzaakt weer met, zeker in Noordwest-Europa, een grote variabiliteit waarbinnen het heel goed mogelijk is een strenge winter te hebben terwijl gemiddeld de temperatuur op aarde voortdurend toeneemt.
Energiebalans van de aarde
De aarde en haar atmosfeer vormen samen een complex systeem. Echter, als van daaruit naar de ruimte wordt gekeken, is dit systeem verbluffend eenvoudig te karakteriseren: de planeet aarde is een open systeem voor energie in de vorm van straling. De enige manier waarop de aarde energie kan ontvangen of kwijtraken aan de omringende ruimte is straling, dus alléén straling kan het systeem aarde binnentreden of verlaten.
Twee soorten straling spelen hierbij een hoofdrol:
• zonnestraling: straling afkomstig van de zon, die ervaren wordt als zichtbaar licht
• warmtestraling: (infrarood)straling die gevoeld wordt als warmte, bijvoorbeeld van een gloeiende kachel of een warmtelamp, maar niet door de mens gezien kan worden
De aarde kan hiermee als volgt gekarakteriseerd worden:
• input is de straling afkomstig van de zon, maar hiervan bereikt een deel de aarde niet door directe reflectie van zonlicht (albedo)
• output is de warmtestraling afkomstig van het aardoppervlak en de atmosfeer.
Als open energiesysteem moet de aarde voldoen aan de wet van behoud van energie: energie kan niet verloren gaan en ook niet uit het niets ontstaan. De energie van het universum is constant. Als de aarde meer straling ontvangt dan ze uitzendt dan neemt de hoeveelheid op aarde vastgelegde energie toe: er wordt een netto hoeveelheid warmte Q vastgehouden. Het gevolg daarvan is weer dat de temperatuur oploopt want in het algemeen geldt immers dat Q = mcpΔT, oftewel een hoeveelheid warmte Q vertaalt zich in opwarming van de massa (m) aan het oppervlak van de aarde (bodem, atmosfeer en water in zeeën en oceanen). Andersom zal de hoeveelheid energie vastgelegd op aarde kleiner worden als er meer output van straling naar de ruimte is dan dat er binnenkomt: de aarde koelt af. Doordat de onbalans relatief klein is, de op te warmen massa groot en het weer inherent variabel, is het voor een individu moeilijk waar te nemen dat er iets verandert. De verandering gaat heel geleidelijk, over tientallen zoniet honderden jaren, oorzaak en gevolg liggen in de tijd uit elkaar (het systeem reageert traag) en de waarneming wordt bemoeilijkt door natuurlijke variatie in het weer.
Op basis van informatie over toe- en afvoer van energie (straling afkomstig van de zon, reflectie zonlicht, warmtestraling) kan de energiebalans van de aarde opgesteld worden en het broeikaseffect berekend worden.
Straling afkomstig van de zon
Zonlicht is een vorm van elektromagnetische straling. Straling is te karakteriseren door haar golflengte λ en/of frequentie ν. Er geldt:
ν = c / λ
met:
ν = frequentie [Hz] of [s-1] (wordt ook wel aangeduid met het symbool f)
c = lichtsnelheid [m/s] (= 3·108 m/s)
λ = golflengte [m] (meestal [nm])
Zonlicht bestaat uit een spectrum van straling dat loopt van (ultra)violet tot (infra)rood. De golflengte van voor het menselijk oog zichtbaar licht loopt van ca. 400 nm (violet) tot 700 nm (diep rood). Aan de buitenkant van de aardse atmosfeer is de intensiteit van zonnestraling, in een vlak loodrecht op de zonnestraling, ca. 1370 W/m2.
Straling vertegenwoordigt energie. Licht, infraroodstraling, röntgenstraling, bestaat uit fotonen. Fotonen vertegenwoordigen discrete pakketjes energie: energie is gekwantiseerd. De energie van fotonen neemt toe als de lichtfrequentie toeneemt en de golflengte dus afneemt. UV-straling (λ = 350 nm) is energierijker dan infraroodstraling (λ = 10000 nm) en röntgenstraling is weer energierijker dan UV-straling. Van UV-straling is bekend dat het schade kan toebrengen aan de huid. Deze straling is namelijk zo energierijk dat bindingen in het DNA verbroken kunnen worden waarna in het slechtste geval huidkanker kan ontstaan. Deze reactie is vergelijkbaar met de reactie voor de fotochemische splitsing van water.
Naast fotochemische reacties interacteren fotonen ook fysiek met stoffen en deeltjes in de atmosfeer:
• lichte deeltjes (waterdruppels, woestijnstof, ijskristallen) reflecteren straling, fotonen
• donkere deeltjes (roet, stof) absorberen straling, fotonen
Reflectie en absorptie van straling staan aan de basis van de reflectie van zonlicht en het broeikaseffect.
Reflectie van zonlicht (albedo)
De albedo van de aarde is gedefinieerd als de reflectiefactor voor zonlicht, gemiddeld over de aarde. De albedo betreft zonlicht dat wordt teruggekaatst de ruimte in (dus over de systeemgrens van het systeem aarde). De albedo van de aarde wordt bepaald door de mate waarin het aardoppervlak dan wel elementen in de atmosfeer (wolken) zonlicht terugkaatsen. Dit is een fysieke eigenschap van oppervlaktes. Een materiaal of oppervlak met een albedo van 0,5 weerkaatst precies evenveel zonnestraling als ze absorbeert.
In het algemeen geldt dat hoe witter, hoe hoger de albedo en hoe donkerder, hoe lager de albedo. Werkelijk gemeten albedo's variëren van 0,9 (verse sneeuw) tot 0,05 (vers asfalt, houtskool).
Een oppervlak gevormd door zeeijs heeft een albedo van 0,5-0,7 en diep zeewater heeft een albedo van slechts ongeveer 0,1. Natuurlijk bos heeft een albedo van 0,1-0,2, afhankelijk van de boomsoorten en dichtheid, terwijl woestijn een albedo heeft van 0,5. Wolken in de atmosfeer hebben een albedo van 0,1 tot 0,8 afhankelijk van het type bewolking. Dit betekent dat veranderingen aan het oppervlak van de aarde én de mate van en type bewolking de totale weerkaatsing van de aarde beïnvloeden. Als het zeeijs op de Noordpool smelt, zal de albedo van de aarde afnemen en zal meer zonnestraling door het oceaanwater worden geabsorbeerd. Dit is een destabiliserende meekoppeling. Andersom, als er op de zuidpool meer en vaker verse sneeuw valt, neemt de albedo van de aarde enigszins toe, en wordt er meer zonnestraling terug de ruimte in gekaatst.
De albedo van de aarde, gemiddeld over het totale aardoppervlak, is ca. 0,3. Dat betekent dus dat gemiddeld 30% van de invallende zonnestraling (licht) als zichtbaar licht wordt teruggekaatst. Dat is ook de reden dat de aarde in het heelal waargenomen kan worden, zoals op onderstaande, beroemde foto die op 7 december 1972 op een afstand van ongeveer 29.000 km werd genomen door de bemanning van de Apollo 17.
Warmtestraling
Elk zwart lichaam met een temperatuur boven het absolute nulpunt zendt straling uit, de zogenaamde 'black body radiation'. Deze straling heeft een spectrum met een klassieke vorm.
Een groot deel van de straling die de aarde uitzendt is infraroodstraling of warmtestraling. Deze straling wordt infrarood genoemd omdat ze een golflengte heeft groter dan rood licht en daarmee voor de mens onzichtbaar is. De binnenkomende zonnestraling bevat ook infraroodstraling, maar de piekintensiteit van straling van de zon ligt bij een veel kortere golflengte. Dat komt doordat het oppervlak van de zon een temperatuur heeft van ca. 6000 K. De wet van Wien geeft dit aan:
λpiek [nm] = 2,9·106 / T [K] (wet van Wien)
Als in bovenstaande wet de temperatuur van de zon, 6000 K, wordt ingevuld dan wordt voor zonnestraling een λpiek van 483 nm gevonden. Voor de aarde wordt ongeveer 10.000 nm gevonden.
Naast de aard van de straling, onder meer gekarakteriseerd door de piekintensiteit in het spectrum, is het natuurlijk belangrijkrijk hoeveel straling de aarde uitzendt. Dit kan bepaald worden op basis van het werk van de natuurkundigen Stefan en Boltzmann. Hun werk heeft geleid tot de wet van Stefan-Boltzmann (1884), die zegt dat de straling uitgezonden door een ideaal zwart lichaam evenredig is met de oppervlaktetemperatuur van dat lichaam tot de 4e macht:
S = σ · T4 (wet van Stefan-Boltzmann)
met:
S = hoeveelheid straling uitgezonden door een ideaal zwart lichaam [W/m2]
σ = constante van Stefan-Boltzmann [W/m2/K4] (= 5,67·10-8 W/m2/K4)
Hoeveel energie de aarde uitzendt kan berekend worden door de aarde te beschouwen als een zwart lichaam met een bepaalde (gemiddelde) oppervlaktetemperatuur. Er geldt:
Saarde = ε · σ · T4
met:
ε = emissiviteit, de mate waarin een echt oppervlak straalt als een ideaal zwart lichaam. Voor de aarde als geheel ligt deze waarde dicht bij 1.
T = (gemiddelde) temperatuur van het aardoppervlak [K]
Natuurlijk broeikaseffect
De energiebalans van de aarde kan opgesteld worden door de aarde te beschouwen als een kale bol in de ruimte met als energiestromen:
• in: zonnestraling, Sin, met een grootte van 1370 W/m2 aan de buitenkant van de atmosfeer (S0), maar een deel van deze S0 wordt gereflecteerd waardoor Sin kleiner is dan S0
• uit: warmtestraling, S, met een grootte van σ · T4 (wet van Stefan-Boltzmann)
Dit is schematisch weergegeven in onderstaande figuur.
Vanuit de zon gezien is het oppervlak Az waarop de aarde netto zonnestraling ontvangt gelijk aan het oppervlak van een platte schijf met de straal van de aarde, r. Dit oppervlak is constant, net als de intensiteit van de zonnestraling, en er geldt: Az = πr2. In werkelijkheid is de aarde bolvormig met oppervlak A = 4πr2. Met een albedo van de aarde, a, gelijk aan 0,3 geldt daarmee voor de gemiddelde geabsorbeerde inkomende zonnestraling:
Sin = (1 - a) · S0 · πr2 / 4πr2 = (1 - a) · S0 / 4 = (1 - 0,3) · 1370 / 4 = 240 W/m2
Ervan uitgaande dat de in- en uitgaande energiestromen aan elkaar gelijk zijn en met toepassing van de wet van Stefan-Boltzmann volgt hieruit:
Suit = Sin = 240 W/m2 = ε · σ · T4
en door invullen van:
σ = 5,67 · 10-8 W/m2/K4 (constante van Stefan-Boltzmann)
ε = 1 (emissiviteit van de aarde)
levert dit een temperatuur van 255 K, ca. -18 °C, op. De werkelijke gemiddelde temperatuur op aarde is 15 °C. Het model van de aarde als een kale bol is dus niet voldoende volledig om de waargenomen temperatuur op aarde te verklaren. De atmosfeer moet hierbij betrokken worden.
Invloed van de atmosfeer
Uit het voorgaande blijkt dat als de aarde, net als de maan, geen atmosfeer zou hebben, de gemiddelde temperatuur op aarde ca. 33 °C lager zou zijn dan de werkelijk gemiddelde temperatuur op het aardoppervlak, 15 °C. Dit verschil wordt veroorzaakt door de aardse atmosfeer, op kosmische schaal bezien een ca. 100 km dunne laag ijl gas. Deze atmosfeer houdt kennelijk een deel van de door het aardoppervlak uitgaande warmtestraling tegen en kaatst deze als het ware terug naar de aarde. Op de tijdschaal van millennia heeft zich vervolgens een evenwicht ingesteld waardoor de gemiddelde temperatuur op aarde de afgelopen eeuwen ca. 15 °C bedraagt.
De atmosfeer kan beschouwd worden als een eenvoudige plaat die een deel van de uitgestraalde infraroodstraling terugkaatst naar het aardoppervlak, zoals schematisch weergegeven in onderstaande figuur (naar Archer (2007)).
Er geldt, met toepassing van:
Sin,zon = (1 - a) · S0 / 4
Szwart lichaam = ε · σ · T4
voor de energiebalans van de atmosfeer:
Suit,atmosfeer + Sterug,atmosfeer = Suit, aardoppervlak
2ε · σ · T4atmosfeer = ε · σ · T4aardoppervlak
voor de energiebalans van het aardoppervlak:
Suit, aardoppervlak = Sin,zon + Sterug,atmosfeer
ε · σ · T4aardoppervlak = (1 - a) · S0 / 4 + ε · σ · T4atmosfeer
en voor het gehele systeem:
Suit,atmosfeer = Sin,zon
ε · σ · T4atmosfeer = (1 - a) · S0 / 4
Dit stelsel van vergelijkingen is als volgt op te lossen voor Taardoppervlak en Tatmosfeer zodat de drie balansen kloppen. Uit de laatste balans kan de atmosfeertemperatuur uitgerekend worden zoals hiervoor gedaan is voor de aarde zonder atmosfeer. Dit is de zogenaamde huidtemperatuur (skin temperature) van de aarde en die bedraagt 255 K, zoals hiervoor al uitgerekend.
Vervolgens kan deze temperatuur ingevuld worden in de balansvergelijking voor de atmosfeer:
2ε · σ · T4atmosfeer = ε · σ · T4aardoppervlak
Taardoppervlak = 21/4 · Tatmosfeer = 1,19 · Tatmosfeer
Dit laagmodel kan uitgebreid worden naar 2, 3, veel lagen, waardoor een steeds uitgebreider stelsel van op te lossen vergelijkingen ontstaat. Hoe meer lagen toegepast worden, hoe dichter de oplossing bij de werkelijke gemiddelde temperatuur ligt. In werkelijkheid bestaat de atmosfeer niet uit een plaat, of meerdere platen, die infraroodstraling terugkaatsen, maar bevinden zich broeikasgassen in de atmosfeer.
Broeikasgassen
Svante Arrhenius (1859-1927) was de eerste die voorspelde dat een planeet, de aarde, op kan warmen door de aanwezigheid van broeikasgassen in een planetaire atmosfeer. Hij ontwikkelde de formule:
ΔF = α · ln(c/c0)
met:
F = energieflux
c = concentratie broeikasgas
c0 = beginconcentratie broeikasgas
α = een te berekenen constante
Arrhenius stelde dus al vast dat er een logaritmisch verband is tussen de concentratie van een broeikasgas en de werking ervan. Inderdaad stelt de wet van Lambert-Beer dat voor de transmissie van licht door een medium geldt:
T = I/I0 = 10αl
Daarin is I de intensiteit van het licht, α de absorptiecoëfficient van het medium en l de lengte van de door het licht afgelegde weg door het medium. Voor bijvoorbeeld oplossingen van kleurstoffen in (helder) water of gassen in de atmosfeer kan α worden uitgedrukt in het product van een molaire absorptiecoëfficient ε en de concentratie van de kleurstof respectievelijk het gas.
Stel bijvoorbeeld dat slappe 'Earl Grey'-thee een absorptiecoëfficient van 0,2 per glas heeft. Als er dan door een glas thee gekeken wordt, is 80% van het van onder ingestraalde licht te zien. Worden twee glazen op elkaar gestapeld dan is 0,82 = 0,64 van dat licht te zien en met vier glazen nog maar 0,84 = 0,4. Als er maar genoeg glazen op elkaar gestapeld worden (of sterkere thee wordt gezet), dan is op een gegeven moment het van onder ingestraalde licht niet meer te zien. Dit is de reden dat het zelfs in helder zeewater op dieptes van ca. 100 m of meer aardedonker is.
Absorptie van licht door vaste oppervlakken, vloeistoffen en gassen verschilt enigzins. Zoals bij reflectie van zonlicht aangegeven, absorberen oppervlakken beter zonlicht naarmate ze donkerder zijn (kleinere albedo). Door de absorptie van zonnestraling kunnen stenen muren, zonnecollectoren etc. in de loop van de dag flink in temperatuur stijgen. In vloeistoffen en gassen wordt licht weliswaar geabsorbeerd, maar ook direct weer uitgezonden. Echter, waar (zon)licht uit één richting afkomstig is, wordt geabsorbeerd licht in willekeurige richting uitgezonden. Dat verklaart het exponentiële verloop van de absorptie. In diepe zeeën en oceanen wordt zonnestraling uiteindelijk zo geabsorbeerd en omgezet in warmte. In de atmosfeer wordt warmtestraling van de aarde ingevangen en voor een deel teruggekaatst naar de aarde, en voor een klein deel omgezet in temperatuurverhoging van de atmosfeer.
De mate van absorptie voor licht of straling met een bepaalde golflengte wordt bepaald door de structuur van een gas. Elke stof heeft een specifiek absorptiespectrum: als deze in een referentiegas met bepaalde concentratie wordt gebracht, zal altijd voor elke frequentie van straling dezelfde mate van absorptie optreden. Van elk gas, dus ook van de gassen aanwezig in de aardse atmosfeer, kan dus (met een infrarood-spectrometer) in een laboratorium worden vastgesteld in welke mate ze straling absorbeert. Als dit wordt gedaan als functie van de golflengte dan wordt het absorptiespectrum verkregen.
Zo is bekend dat waterdamp (H2O), kooldioxide (CO2), distikstofoxide (N2O) en methaan (CH4) in sterke mate infraroodstraling absorberen. Deze gassen zijn altijd aanwezig in de atmosfeer, in min of meer constante concentraties. Door de absorptiespectra op te tellen, en rekening te houden met hun concentraties in de atmosfeer en de dikte, wordt het absorptiespectrum van de aardse atmosfeer verkregen. Dit is het spectrum zoals dat te zien is vanuit de ruimte.
Atmospheric window
In onderstaande figuur is het absorptiespectrum van de aardse atmosfeer weergegeven. De vijf vloeiende lijnen zijn het spectrum van straling dat de aarde uitzendt bij resp. 220, 240, 260, 280 en 300 K. N.B.: op de horizontale as staat het golfgetal (wavenumber), niet de golflengte. Het golfgetal, n, wordt uitgedrukt in cycles per centimeter. Bij een golflengte van 10000 nm is het aantal cycles per centimeter:
n = (10-2 [m]/[cm]) / (λ [nm] · 10-9 [m]/[nm]) = (10-2) / (10000 · 10-9 ) = 1000 cm-1
Bij een golflengte van 5000 nm (kortere golflengte, meer naar zichtbaar licht) is het golfgetal 2000 cm-1.
Het in de figuur weergegeven spectrum is gegenereerd met klimaatmodel MODTRAN van de universiteit van Chicago. MODTRAN is een zgn. 'line-by-line' model, dat voor elke golflengte uitrekent hoeveel de aardse atmosfeer doorlaat. De blauwe modellijn geeft aan welke straling een waarnemer (met infrarood-spectrometer) 'ziet' op 70 km boven het aardoppervlak. De overige, vloeiende lijnen geven het emissiespectrum van de aarde weer bij verschillende gemiddelde oppervlaktetemperaturen. De in de figuur gepresenteerde 'model run' is gemaakt met de standaardinstellingen van het model, nl.: 400 ppm CO2, 1,7 ppm CH4, 28 ppb troposferisch O3, geen wolken of regen etc.
In het absorptiespectrum van de aardse atmosfeer (de blauwe modellijn in de figuur) zorgen waterdamp, CO2, O3 en CH4 voor een sterke absorptie. Van golfgetal 200 tot ca. 580 cm-1 is de blauwe lijn sterk gekarteld. In dit gebied wordt voor sommige golflengtes een deel van de straling doorgelaten, terwijl voor andere golflengtes een groot deel van de straling wordt geabsorbeerd door de waterdamp aanwezig in de atmosfeer. Dat is te zien aan de relatief grote afstand tot de vloeiende oranje en rode lijnen, die respectievelijk het stralingspectrum bij 280 en 300 K weergeven (resp. 7 en 27 °C).
In het gebied van het absorptiespectrum met golfgetal 600 tot 1300 cm-1 zijn twee gebieden waar straling ongehinderd kan ontsnappen: straling met een golfgetal 800-1000 cm-1(golflengte van 12000 tot 10000 nm) wordt bijna ongehinderd doorgelaten door de aardse atmosfeer, en er is een wat kleiner 'window' bij golfgetal 1100-1300 cm-1 (golflengte van 9100 to 7700 nm). Samen vormen deze twee gedeelten van het spectrum het zogenaamde atmospheric window. Links daarvan en tussen de twee gebieden in bevindt zich het golflengtebereik waar CO2 (golfgetal 600-800 cm-1) resp. ozon (rond golfgetal 1100 cm-1) de warmtestraling absorbeert. In deze gebieden absorbeert de atmosfeer een groot deel van de door de aarde uitgezonden warmtestraling. Op de websitew van de universiteit van Chicago kan bekeken worden hoe het absorptiespectrum verandert als de CO2-concentratie in de atmosfeer toeneemt.
Het toevoegen van stoffen aan de atmosfeer die juist in het gebied van de atmospheric window infraroodstraling absorberen heeft een relatief groot effect op de broeikaswerking van de atmosfeer. Eén zo'n gas is bijvoorbeeld SF6, dat vrijkomt bij de fabricage van aluminium. Dit gas heeft dan ook een groot Global Warming Potential (GWP), net als sommige gehalogeneerde koolwaterstoffen.
Versterkt broeikaseffect
Aan de vergelijking van Arrhenius is al te zien dat naarmate de concentratie van een broeikasgas stijgt, het absolute effect van die stijging kleiner wordt. De absorptie van straling door de atmosfeer, en daarmee de onbalans in de aardse energiebalans uitgedrukt als 'radiative forcing' (RF), is evenredig met de logaritme van de CO2-concentratie: het effect van een CO2-stijging van 270 naar 540 ppm is even groot als het effect als de CO2-concentratie toeneemt van 540 naar 1080 ppm etc. Juist de verandering in concentratie van een broeikasgas dat niet of maar zeer beperkt in de atmosfeer aanwezig is, heeft een relatief groot effect.
Zoals aangegeven bij de klimaatmodellen leidt de opwarming van de oceanen tot grotere verdamping van water én tot een hogere evenwichtsconcentratie van water in de atmosfeer. De concentratie aanwezige waterdamp in de atmosfeer is echter al zó groot dat deze absorptie in het gedeelte van het emissiespectrum van de aarde waar water infraroodstraling absorbeert al meer dan 90% van de theoretisch maximale waarde is. Dit betekent dat een verhoging van de concentratie water in de atmosfeer het broeikaseffect nauwelijks verder zal versterken.
Gelukkig is daarmee ook de dreiging van ten minste één versterkend werkende meekoppeling beperkt: opwarming van de oceanen zorgt voor meer verdamping van water, een hogere evenwichtsconcentratie waterdamp in de atmosfeer, meer broeikaseffect en verdere opwarming. Dat is maar goed ook, want anders dan de CO2- en CH4-concentratie in de atmosfeer stelt de evenwichtsconcentratie voor water zich zeer snel in, namelijk in een tijdsbestek van enkele weken. Anderzijds is ook een zeer grote verlaging van de evenwichtsconcentratie van water (wat nodig zou zijn om de broeikaswerking van water te verminderen) onwaarschijnlijk gegeven de verwachte opwarming van de oceanen.
De redenering van sommige klimaatsceptici dat een toename van CO2 in de atmosfeer géén versterkt broeikaseffect teweeg kan brengen doordat in vergelijking met de 400 ppm CO2 de concentratie van water veel hoger is, houdt dus geen stand: het water in de atmosfeer zorgt voor een groot en stabiel deel van het broeikaseffect.
Doordat het broeikaseffect van water in de atmosfeer al bijna zijn maximale waarde heeft, heeft een toe- of afname van de hoeveelheid waterdamp in de atmosfeer maar een klein, zoniet verwaarloosbaar effect op het versterkt broeikaseffect. Bij CO2 en andere broeikasgassen als CH4 en N2O is de situatie precies omgekeerd: doordat de natuurlijke evenwichtsconcentratie van deze stoffen in de atmosfeer klein is, leidt een op zichzelf kleine toename tot een aanzienlijk versterkt broeikaseffect.
Als de hoeveelheid verdamping toeneemt zal de totale hoeveelheid water in de atmosfeer verder toenemen doordat er dan meer wolkvorming zal optreden. Ook zal het meer regenen. Het effect van een verhoogde verdamping en evenwichtsconcentratie waterdamp in de atmosfeer op de vorming van wolken is overigens nog slecht begrepen. Er wordt dan ook veel onderzoek gedaan om de modellen voor vorming van (verschillende typen) wolken, hun levensduur en effect op de stralingsbalans van de aarde verder te preciseren.
Global Warming Potential
Sommige gassen hebben een (veel) grotere invloed op het versterkt broeikaseffect dan andere gassen:
• er zijn gassen, bijvoorbeeld SF6, die infraroodstraling absorberen in het atmospheric window, terwijl andere dit alleen in het gebied van H2O en CO2 doen
• van veel broeikasgassen is de beginconcentratie in de atmosfeer laag, waardoor het effect van een kleine concentratiestijging al direct groot is
• broeikasgassen kunnen kort (weken) of lang (honderden jaren) in de atmosfeer blijven voordat ze worden afgebroken of met regen worden uitgespoeld
Het zijn deze drie aspecten die tot uitdrukking komen in het Global Warming Potential (GWP) van een individueel (broeikas)gas. Het GWP is een relatieve maat en wordt uitgedrukt in het effect over een bepaalde tijdsperiode van het brengen van 1 ton van een stof in de atmosfeer t.o.v. het brengen van 1 ton CO2 in de atmosfeer. Deze tijdsperiode (20, 100 of 500 jaar) is van belang doordat stoffen uit de atmosfeer worden verwijderd en/of in de atmosfeer worden afgebroken waardoor het GWP over 20, 100 of 500 jaar verschillend is. Het Global Warming Potential moet niet verward worden met de Radiative Forcing (RF).
Stoffen die straling absorberen in het atmospheric window, een lage beginconcentratie en een lange levensduur hebben, hebben een hoge GWP. De meeste chloorfluorkoolwaterstoffen, de CFK's, vallen in deze categorie. CFK-11 heeft bijvoorbeeld een GWP100 van 4750, zie onderstaande tabel. De meeste vluchtige koolwaterstoffen hebben ook een hoog GWP. De GWP20 van methaan is bijvoorbeeld 72. Dit betekent dat 1 kg methaan 72 keer zoveel bijdraagt aan het GWP als 1 kg van de CO2 die resulteert na verbranding van methaan. Per molecuul of mol is dat (72/44*16 =) 26 keer zoveel. Het GWP van methaan zou hoger zijn als het niet in gemiddeld 2 jaar zou worden afgebroken in de atmosfeer. Het GWP kan bijvoorbeeld worden gebruikt in de CO2-emissiehandel. Met behulp van het GWP kan de uitstoot van andere broeikasgassen dan CO2 ook beprijsd worden; de uitstoot van één ton methaan komt volgens de GWP100 bijvoorbeeld overeen met de uitstoot van 25 ton CO2.
| Stof | Formule | GWP100w |
| Kooldioxide | CO2 | 1 |
| Methaan | CH4 | 25 |
| Lachgas | N2O | 298 |
| Chloroform | CHCl3 | 13 |
| Methylchloroform | CH3CCl3 | 146 |
| Tetra | CCl4 | 1400 |
| CFK-11 | CCl3F | 4750 |
| CFK-12 | CCl2F2 | 10900 |
| CFK-13 | CClF3 | 14400 |
| HFK-23 | CHF3 | 14800 |
| Zwavelhexafluoride | SF6 | 22800 |
Kooldioxide, methaan en lachgas (N2O) zijn met ozon de belangrijkste broeikasgassen in de troposfeer. Uit de tabel blijkt dat vooral chloor-fluor-koolwaterstoffen (CFK's) een sterke broeikaswerking hebben. Sinds de aanname van het Protocol van Montreal (1987) en de in werking treding van dit protocol (1989) om de verdere afbraak van de ozonlaag te stoppen, wordt de uitstoot van deze stoffen wereldwijd teruggedrongen. Echter, de enige tijd ter vervanging gebruikte HFK's hebben ook hoge GWP's.
Radiative Forcing
De energiebalans van de aarde is in evenwicht als de uitgaande warmtestraling gelijk is aan de hoeveelheid ingevangen zonnestraling. Bij de bespreking van het broeikaseffect is aangegeven dat beide 240 W/m2 zouden moeten bedragen. Radiative Forcing (RF, stralingsforcering) wordt gebruikt om de sterkte van natuurlijke of door de mens veroorzaakte processen te kwantificeren die de energiebalans van de aarde verstoren. De RF van deze processen wordt uitgedrukt in W/m2 en is positief als er netto energie-accumulatie optreedt of anders gezegd: als er een onbalans in de stralingsbalans ontstaat waardoor minder straling het systeem aarde zal verlaten.
In onderstaande figuur, afkomstig uit het 4e assessment reportw van het IPCC (IPCC (2007)) is af te lezen dat de RF van CO2 het meest positief is met 1,66 W/m2. Naast de inbreng van broeikasgassen zoals CO2, CH4 en N2O in de atmosfeer zijn er nog andere menselijke activiteiten die van invloed zijn op de energiebalans, de stralingsbalans, van de aarde. In haar samenvatting voor beleidsmakers (IPCC (2007)) rapporteert het IPCC deze invloeden uitgedrukt als RF. Onderstaande figuur is daarmee een samenvattend resultaat cq. overzicht van de kennis van het klimaat en de menselijke invloed daarop, zoals neergelegd in meetreeksen, modellen en hun verklaring.
Volgens de figuur zijn de belangrijkste invloeden op de aardse energiebalans:
• CO2: de verandering van de CO2-concentratie van ca. 280 ppm (pre-industriële revolutie) naar 380 ppm (2005)
• CH4, N2O (lachgas) en gehalogeneerde koolwaterstoffen: dit zijn drie gassen waarvan de concentratie in de atmosfeer door menselijke activiteiten is toegenomen
• O3: hier wordt onderscheid gemaakt tussen ozon in de troposfeer (de lagere luchtlagen) en de stratosfeer, waar zich de ozonlaag bevindt. De hoeveelheid O3 in de troposfeer is toegenomen, o.a. door het verkeer; stratosferisch ozon is afgenomen, wat ook bekend staat als de afbraak van de ozonlaag. Doordat ozon een broeikasgas is, resulteert dit in een positieve resp. negatieve RF
• H2O in de stratosfeer: hier bevindt zich normaliter geen water, maar doordat CH4 hier wordt afgebroken vindt toch toename van de H2O-concentratie plaats
• albedo van het aardoppervlak: door veranderend landgebruik, ijs- en sneeuwbedekking verandert de albedo
• aerosolen: dit zijn kleine zwevende deeltjes in de atmosfeer die enerzijds zelf zonlicht reflecteren, anderzijds wolkvorming stimuleren
• lineaire condensatiesporen gevormd door roetdeeltjes (condensatiekernen) en water afkomstig van vliegtuigen (verbranding van kerosine)
Daarnaast is nog het effect van de wisselende zonne-instraling weergegeven. De activiteit van de zon en daarmee de hoeveelheid zonlicht die de aarde bereikt is niet constant. De zon wisselt perioden van wat grotere activiteit af met perioden van mindere activiteit. Astronomen zien meer resp. minder zonnevlekken (grote uitbarstingen van heet gas aan het zonneoppervlak) ontstaan. Als de zonneactiviteit laag is neemt ook de zonnestraling iets af.
In bovenstaande figuur is af te lezen dat de broeikasgassen een positieve RF kennen, en daarmee het broeikaseffect versterken, terwijl de verandering van landgebruik en aerosolen een negatieve RF hebben, en daarmee het broeikaseffect verzwakken. In 2007 was de consensus, op basis van de toen beschikbare kennis en gegevens, dat er een totale RF bestaat van 1,6 ± 0,8 W/m2.
Uit de wet van Stefan-Boltzmann kan dan een eerste schatting berekend worden voor de nieuwe (gemiddelde) evenwichtstemperatuur:
Szwart lichaam = ε · σ · T4
differentiëren:
dS = 4ε σ T3 · dT
delen door de oorspronkelijke vergelijking:
dS / S = 4 · dT/T
dT = dS · T / S / 4
invullen:
dT = 1,6 · 288 / 240 / 4 = 0,48 ± 0,24 K
Deze temperatuurstijging komt min of meer overeen met de stijging van het langjarig gemiddelde van de gemiddelde temperatuur op aarde sinds de metingen 157 jaar geleden begonnen. In het vijfde assessment report uit 2014 komen de wetenschappers voor 2011 uit op een hogere RF dan de hiervoor genoemde 1,6 W/m2, namelijk 2,29 (1,13 - 3,33) W/m2 t.o.v. het jaar 1750 (IPCC/WG1w).
Koppelingen in het klimaatsysteem
Zoals hiervoor al is aangegeven wordt het klimaat, de stabiliteit en de ontwikkeling daarvan in sterke mate bepaald door mee- en tegenkoppelingen in het systeem. Nog niet alle koppelingen zijn geïdentificeerd, terwijl bekende koppelingen niet noodzakelijkerwijs juist gemodelleerd hoeven te zijn. Daardoor zijn werkelijke variaties in het klimaat hoogstwaarschijnlijk groter dan de modellen voorspellen (Archer (2007)).
De belangrijkste thans bekende koppelingen in het klimaatsysteem zijn:
• waterdampkoppeling: water houdt van alle broeikasgassen in de atmosfeer de meeste straling tegen. Als om welke reden dan ook de temperatuur op aarde toeneemt dan verdampt er meer water naar de atmosfeer, waardoor deze meer straling tegenhoudt enzovoort. Zoals eerder besproken wordt bij de huidige concentratie waterdamp in de atmosfeer al meer dan 90% van de maximaal te absorberen straling ook geabsorbeerd. Tevens geldt dat bij elke temperatuur de atmosfeer maar een bepaalde, maximale hoeveelheid vocht kan bevatten. Wordt door toegenomen verdamping de relatieve luchtvochtigheid groter dan 100% (groter dan deze maximale hoeveelheid), dan zit er meer water in de atmosfeer dan deze bij de geldende temperatuur kan bevatten als damp en zal druppelvorming optreden. Er ontstaan wolken, en uiteindelijk gaat het regenen. In de aardse atmosfeer stabiliseert de hoeveelheid waterdamp zich hierdoor op enig moment bij een bepaalde gemiddelde temperatuur. Op de planeet Venus heeft deze koppeling wel geleid tot een runaway broeikaseffect. Dat komt doordat Venus veel dichter bij de zon staat, waardoor de beschreven koppeling niet in een stabiel punt terecht is gekomen. De zonne-instraling is op Venus bijna 2x zo groot als op aarde (2600 W/m2). Zonder atmosfeer zou de gemiddelde temperatuur 240 K bedragen, terwijl de gemeten temperatuur maar liefst 700 K is.
• ijs-albedo-koppeling: dit is een koppeling die zichzelf zowel richting afkoeling als opwarming kan versterken. Helaas geven alle meetreeksen en modelberekeningen aan dat het met name op het Noordelijk halfrond om een versterking richting opwarming gaat. Door de afname van de zeeijsbedekking neemt de albedo ter plaatse sterk af, wat weer tot gevolg heeft dat de zeewatertemperatuur ter plaatse en daarmee de gemiddelde temperatuur oploopt, waardoor meer ijs smelt enzovoort. Inmiddels wordt voor het Noordpoolgebied rekening gehouden met een temperatuurstijging die 2 tot 4 keer groter is dan het wereldwijde gemiddelde.
• wolken: deze koppeling is complex en nog niet goed begrepen. Wolken houden warmtestraling van het aardoppervlak tegen, maar stralen aan de bovenkant eveneens warmte uit (als zwarte lichamen). Wolken weerkaatsen eveneens inkomend zonlicht. Deze drie processen zijn allemaal afhankelijk van het type wolk, de dikte en de verticale positie van de wolk in de atmosfeer, waarmee modelleren en voorspellen erg lastig wordt doordat wolkvorming afhankelijk is van de hoeveelheid waterdamp, luchtstroming (drukverschillen in de atmosfeer) en het aantal condensatiekernen.
• oceaanstromingen: wereldwijd is er in de oceanen zogenaamde thermohaliene circulatie: zeewater dat stroomt door een combinatie van de zwaartekracht en dichtheidsverschillen. Opwarming van de aarde zou deze circulaties kunnen beïnvloeden, bijvoorbeeld de frequentie tussen het optreden van el Niño en la Niña in de Stille Oceaan. Ook zou de warme golfstroom in onze regio, onderdeel van de grote Noord-Atlantische circulatie kunnen afnemen of zelfs geheel tot stilstand kunnen komen, een gebeurtenis die zich in de geologische geschiedenis al meermalen heeft voorgedaan. Als dat gebeurt, zal de gemiddeld snellere opwarming in Noordwest-Europa omslaan in een daling van de temperatuur, want de warme golfstroom maakt dat het in Noordwest-Europa gemiddeld een aantal graden warmer is dan elders in de wereld op een vergelijkbare breedtegraad. De omslag zou in gang kunnen worden gezet door het sneller afsmelten van ijs op Groenland, waardoor het zoutgehalte en daarmee de dichtheid van het zeewater ter plaatse iets kan afnemen. Daarmee zou de drijvende kracht voor de circulatie wegvallen. Britse onderzoekers hebben in 2007 voor de kust van Afrika metingen verricht op basis waarvan zij concludeerden dat de warme golfstroom al met 50% afgenomen zou zijn. Vooralsnog is deze analyse niet verder bevestigd.
• koppeling met de hydrologische kringloop: als er netto energie accumuleert in het systeem aarde dan moet die energie ergens terecht komen. Onderzoekers hebben vastgesteld dat het grootste deel terecht komt in de oceanen, die daardoor opwarmen. Daarmee wordt de hydrologische kringloop (verdamping boven zee, regen boven land, afstroom terug naar zee) geïntensiveerd. Echter, niet alleen de intensiteit maar ook de patronen in deze kringloop kunnen veranderen. Daardoor kan op sommige plaatsen droogte en verwoestijning ontstaan, andere plaatsen kunnen juist getroffen worden door overvloedige neerslag.
• verwoestijning-albedo-koppeling: als neerslagpatronen veranderen en de temperatuur toeneemt, zal wereldwijd woestijnvorming toenemen. De albedo van land dat verandert van bos in woestijn neemt toe. Daarnaast leidt verwoestijning in combinatie met wind tot meer stof in de atmosfeer, dat eveneens zonlicht reflecteert. Op lange termijn is dit dus een stabiliserende tegenkoppeling.
• biosfeer-koppeling: klimaatverandering heeft veel effecten op de biosfeer. Door de verhoogde CO2-concentratie zullen planten gemiddeld iets harder groeien, waardoor zij meer koolstof vastleggen als biomassa. Echter dit effect wordt door de voortzettende ontbossing in Zuid-Amerika, Azië en Afrika (in het afgelopen decennium ongeveer 13 miljoen hectare per jaar, of 130.000 km2, bijna 5x de oppervlakte van Nederland) meer dan teniet gedaan. Alleen in Noordwest-Europa neemt het areaal bos en de bosopstand al langere tijd elk jaar toe. Ook door verhoogde temperatuur zullen planten harder groeien, maar in combinatie met de koppeling met de hydrologische kringloop zijn er ook gebieden waar plantengroei onmogelijk wordt vanwege droogte. In veel gebieden zijn de veranderingen niet extreem, maar wel groot. Daardoor zullen ecosystemen zich moeten aanpassen. Het klimaat in Nederland werd bijvoorbeeld de afgelopen tien jaar gekenmerkt door gemiddelde temperaturen die vergelijkbaar zijn met de langjarige gemiddelden voor Midden-Frankrijk, en door een veranderend neerslagpatroon: minder dagen dat het miezert, meer relatief intensieve buien waaruit in korte tijd zeer veel neerslag kan vallen.
Naast deze koppelingen bestaan er koppelingen met de koolstofcyclus, namelijk met de langzame en de snelle koolstofkringloop.
Langzame koolstofkringloop
De langzame koolstofkringloop is een geochemische cyclus, waarin rotsen opgebouwd worden en weer verweren. Ook spelen levende organismen hierin een rol, zoals schelpdieren en andere microfauna die een kalkskelet opbouwen. De snelle koolstofkringloop betreft koolstof zoals die circuleert ten gevolge van groei, leven, afsterven én fossiliseren van levende organismen. De hoeveelheid koolstof opgeslagen in sedimentgesteenten is vele malen groter dan de hoeveelheid koolstof in de snelle koolstofkringloop, nl. ongeveer 500 maal zo groot. Enerzijds is die koolstof gevangen als kerogen, fossiel koolstof in gesteente met een concentratie die meestal lager is dan 1 massa%, anderzijds als kalksteen, CaCO3.
De langzame koolstofkringloop betreft de verwering van rotsen en de opbouw van kalksteen:
- kiezel (silicate rock): een complex materiaal dat CaSiO3 bevat en langzaam verweert door een reactie met CO2 uit de lucht: CaSiO3 + CO2 → CaCO3 + SiO2.
- het zo ontstane calciumcarbonaat (CaCO3) en siliciumoxide (SiO2) lossen langzaam op in water en komen uiteindelijk in zee terecht
- in de oceanen bouwen schelpdieren hun schelpen op uit het opgeloste calciumcarbonaat en siliciumoxide
- de schelpdieren sterven, hun schelpen worden sedimentafzetting en uiteindelijk kalksteen
- door geologische processen komen na miljoenen jaren de kalksteenafzettingen aan de oppervlakte, en begint de verwering.
Snelle koolstofkringloop
De snelle koolstofkringloop betreft koolstof zoals die circuleert ten gevolge van groei, leven, afsterven én fossiliseren van levende organismen. Koolstof wordt als CO2 in de atmosfeer gevonden, in biomassa (levende én dode organismen) én in voorraden fossiele grondstoffen. Een vierde belangrijk reservoir van koolstof is de CO2 opgelost in de oceanen. Onderstaande figuur laat de snelle koolstofkringloop zien met in geel de natuurlijke stromen en in rood de bijdrage van de mens. De opgeslagen hoeveelheden koolstof zijn met wit aangegeven.

Snelle koolstofkringloop met hoeveelheden in miljard ton koolstof (per jaar) (bron: Wikimedia Commons)
In de figuur zijn te zien:
• levend koolstof: planten leggen CO2 uit de atmosfeer vast als biomassa. Nadat planten en andere organismen afsterven valt de biomassa weer uiteen in CO2 en H2O.
• fossiel koolstof: een klein deel van de afgestorven biomassa wordt geïsoleerd van de atmosfeer en valt niet uiteen. Op verschillende manieren fossiliseert dit materiaal (bijvoorbeeld veen → turf → bruinkool → steenkool).
• koolstof in gebruik: de mensheid onttrekt koolstof aan fossiele bronnen. Na gebruik resulteert dit in CO2-uitstoot naar de atmosfeer.
Van de verschillende reservoirs, levende en dode biomassa, oceanen, fossiel koolstof en de atmosfeer, is de laatste het kleinst en een ordegrootte kleiner. Dit betekent dat stromen die klein zijn ten opzichte van de hoeveelheid biomassa c.q. fossiele grondstoffen een dramatisch effect kunnen hebben op de accumulatie van CO2 in de atmosfeer. De oceanen bevatten naar schatting zo'n 37.000 Gton koolstof opgelost als CO2, H2CO3, HCO3- en CO32-. De hoeveelheid koolstof in voorraden fossiele grondstoffen is ongeveer 10.000 Gton.
Voor het versterkt broeikaseffect zijn de CO2-concentratie en de CH4-concentratie in de atmosfeer het belangrijkst.
CO2-concentratie
De veranderingen in CO2-concentratie kunnen in beeld worden gebracht door de systeembenadering toe te passen en na te gaan wat de sources en sinks in de koolstofkringloop zijn. Volgens de gegevens van het Carbon Dioxide Information Analysis Center (CDIAC)w, een onderdeel van het US Department of Energy (DOE) bedroeg de pre-industriële (in het jaar 1850) hoeveelheid koolstof in de atmosfeer 613 Gton (GtC) en is daar (tot aan het jaar 2000) door veranderd landgebruik, cementproductie en gebruik van fossiele grondstoffen ca. 174 GtC bijgekomen, zodat de atmosfeer nu zo'n 787 GtC bevat. De totale uitstoot, vanaf het begin van de industriële revolutie, is zo'n 442 GtC. Het verschil, 268 GtC, is opgenomen in de bovenste laag van de oceanen.
Belangrijke sources
• verandering van landgebruik: op alle continenten, met uitzondering van Noordwest-Europa leidt verandering van landgebruik voortdurend tot een netto bron van CO2. Van 1850 tot 2000 was de uitstoot naar de atmosfeer daardoor 154 GtC.
• cementproductie: een belangrijk bestanddeel van cement is ongebluste kalk, CaO. Dit wordt gemaakt in kalkovens, waar door verhitting van kalk, CaCO3, de volgende reactie optreedt: CaCO3 → CaO + CO2. Dus zowel het stoken van de kalkovens als het productieproces zelf veroorzaakt CO2-uitstoot. Van 1850 tot 2000 was deze uitstoot wereldwijd 6 GtC.
• verbranding van fossiele grondstoffen (aardolie, aardgas, steenkool, bruinkool, turf): van 1850 tot 2000 bedroeg de totale CO2-productie hierdoor zo'n 282 GtC.
Belangrijke sinks
• atmosfeer: de belangrijkste eerste sink voor CO2 en andere broeikasgassen is de atmosfeer.
• oceanen: met name voor CO2 zijn de oceanen een belangrijke sink. Ongeveer 60% van de door menselijke activiteiten veroorzaakte CO2-uitstoot is opgenomen door de oceanen.
• biosfeer: biomassa is een sink voor CO2. Echter, zodra levende wezens sterven valt biomassa uiteen (rotting). Wereldwijd zijn alleen de Europese bossen netto een sink voor CO2: de bosopstand groeit daar, waarmee CO2 wordt vastgelegd. Elders ter wereld wordt nog steeds in hoog tempo ontbost.
Koppelingen klimaat en koolstofcyclus
Het klimaat is een complex systeem met vele mee- en tegenkoppelingen. Over een langere tijdspanne bezien kan dit systeem zich in een aantal min of meer stabiele punten bevinden. De werking van de mee- en tegenkoppelingen bepaalt in hoge mate wat de condities zijn bij die stabiele punten.
In de langzame koolstofkringloop zit een terugkoppeling waarmee volgens geochemici de CO2-concentratie wordt ingesteld. Volgens Archer (2007) werkt de silicate weathering thermostat als volgt:
- de verwering van silicaatgesteente is temperatuursafhankelijk: als de temperatuur hoger wordt, verloopt de verweringsreactie met CO2 sneller. Ook als de CO2-concentratie hoger wordt verloopt de reactie sneller. Door de reactie verdwijnt CO2 uit de atmosfeer.
- vanuit het binnenste van de aarde wordt door vulkanische processen CO2 geëemitteerd naar de atmosfeer. Dit is langzame vulkanische ontgassing.
- als bovenstaande processen uit balans zijn, kan op een tijdschaal van honderdduizenden jaren alle CO2 uit de atmosfeer verdwijnen. Echter dat gebeurt niet want er stelt zich een evenwicht in via de CO2-concentratie in de atmosfeer en de gemiddelde temperatuur op aarde.
De geologische tijdschaal is veel langer dan de tijdschaal waarop de koppelingen met/in de snelle koolstofkringloop zich manifesteren. Een aantal daarvan zijn (o.a. Leggett (2005)):
• CO2 in de oceanen: zoals hiervoor aangegeven is ongeveer 60% van de door mensen veroorzaakte onbalans in de snelle koolstofkringloop terecht gekomen in de oceanen en 40% in de atmosfeer. Doordat de verschillende lagen zeewater niet goed mengen, kunnen deze bovenste lagen verzadigd raken met CO2: er is dan een evenwichtsconcentratie bereikt. Als door het versterkt broeikaseffect de temperatuur van het zeewater stijgt, kan het water minder CO2 bevatten c.q. opnemen, waardoor de atmosferische CO2-concentratie sneller zal toenemen, waardoor het broeikaseffect verder wordt versterkt enzovoorts. Een andere, mogelijk versterkende meekoppeling is dat de oceanen licht verzuren door de opname van CO2, waardoor zeeleven kan uitsterven, waardoor de opname van CO2 door algen in de zee vermindert.
• permafrost: in de toendra's op het Noordelijk Halfrond (Siberië, Canada, Alaska) is de bodem tot soms wel een diepte van 10 m permanent bevroren. 's Zomers ontdooit slechts de bovenste laag van deze permafrost. Door de opwarming van het Noordelijk halfrond kan de permafrost tot op grotere diepte permanent ontdooien. Daardoor zullen de grote hoeveelheden biomassa in deze permafrost gaan rotten, waardoor grote hoeveelheden methaan en CO2 in de atmosfeer kunnen komen.
• ineenstorting van ecosystemen: vergeleken met geologische en evolutionaire tijdschalen gaat de opwarming snel. Dat brengt het gevaar met zich mee van ineenstorting van gehele ecosystemen als zij zich niet snel genoeg kunnen aanpassen. Dit risico wordt nog vergroot door het frequenter optreden van droogtes. Gehele bosgebieden zouden daardoor binnen korte tijd kunnen afsterven, wat weer leidt tot een grote CO2-emissie naar de atmosfeer. Recent onderzoek heeft bijvoorbeeld laten zien dat regenval in het Amazonegebied terugloopt, waardoor het regenwoud verdroogt en het bos kan afsterven. Ook wordt de kans op grote bosbranden groter, want nu is het nog zo dat grote delen van het regenwoud zo vochtig zijn dat blikseminslag bijna nooit leidt tot brand. Als dit scenario zich zou afspelen zou een enorme hoeveelheid CO2 in de atmosfeer terecht komen.
• organisch materiaal in de bodem: wereldwijd bevindt zich veel biomassa in bodems. Door het leven aldaar zijn veel bodems netto opnemers van CO2. Door opwarming, dan wel verandering van neerslagpatronen zou deze situatie kunnen veranderen.
De tijdschaal waarop deze effecten zich kunnen voordoen loopt van tientallen jaren tot duizend jaar.
Effecten gerelateerd aan klimaatverandering
Temperatuurstijging leidt tot het smelten van ijskappen en gletsjers, en daarmee tot zeespiegelstijging. Een minstens zo belangrijk effect is dat zeewater niet alleen opwarmt, maar daarmee ook uitzet: het volume wordt groter. Volgens het IPCCw is de wereldwijde zeewaterspiegel tussen 1901 en 2018 met 0,20 tot 0,25 m gestegen en is het vrijwel zeker dat de stijging toenam van ca. 1,3 mm per jaar tussen 1901 en 1971 tot ca. 1,9 mm per jaar tussen 1971 en 2006 en ca. 3,7 mm per jaar tussen 2006 en 2018. Ten opzichte van het jaar 2019 zal de wereldwijd gemiddelde zeewaterspiegel in 2100 naar verwachting 0,5 tot 1 m gestegen zijn (IPCC (2021)). Aangezien een groot deel van de mensheid aan kusten woont zullen veel gebieden, delta's zoals Nederland, hiermee te maken krijgen. Volgens het KNMIw was de stijging van de zeewaterspiegel aan de Nederlandse kust de afgelopen eeuw vergelijkbaar met de wereldwijde stijging en zal de zeespiegelstijging nog eeuwen doorgaan als de temperatuur na 2100 niet meer stijgt.
Het weer zal veranderen doordat de hydrologische kringloop intensiveert door de opwarming en energie-opname van de oceanen. Er zullen meer hittegolven zijn, periodes van droogte en van extreme neerslag. Als gletsjers daadwerkelijk afsmelten, veranderen rivieren als de Rijn en de Rhone in regenrivieren: hun basis-debiet van smeltwater van de gletsjer valt weg.
Voor Nederland betekent dit dat er zowel aandacht aan de zeewering als aan de grote rivieren besteed moet worden: in de herfst en winter zijn extreem hoge debieten te verwachten, in de zomer kan de waterstand juist enorm teruglopen waardoor scheepvaart onmogelijk wordt en de zoetwatervoorziening in het gedrang komt.
Meer intensieve neerslag heeft vooral gevolgen voor de ruimtelijk ordening, bouwen en wonen en de aanleg van (energie)infrastructuur: het is niet gewenst dat gebieden zo ver onder water lopen dat schade optreedt, ICT en elektriciteitsnetwerken uitvallen etc.
Wereldwijd zullen er effecten zijn op ecosystemen, landbouw en voedselvoorziening: landbouw is bij uitstek afhankelijk van water. Droogte en stormen kunnen oogsten doen mislukken. Het is daarom belangrijk om te zoeken naar oplossingsrichtingen.
Oplossingsrichtingen
De technische sleutel ligt in een transitie van de energievoorziening: van koolstofintensief naar koolstofvrij, duurzaam. Echter, hoewel de techniek beschikbaar is, is deze nog niet altijd competitief of betrouwbaar genoeg. Ook ontbreekt de mogelijkheid tot grootschalige opslag van energie, elektriciteit, om bijvoorbeeld het wisselend aanbod aan windenergie op te vangen. Grote systemen zoals het plan voor een Europees supergrid op en rond de Noordzee vergen weer veel coördinatie tussen vele partijen, wat leidt tot onzekerheid en langzame uitvoering. Een andere oplossingsrichting is de opslag van CO2, maar dit loopt tegen technische, economische en sociale problemen aan. Ten slotte is een oplossingsrichting om goed te kijken naar landgebruik en om ontbossing tegen te gaan. Daarmee kan wellicht de albedo een zetje in de goede richting worden gegeven, net als de netto koolstofbalans van de biosfeer.
Energieopslag
Bij de overgang van fossiele naar hernieuwbare energiebronnen zoals wind- en zonne-energie is het belangrijk om goed in te kunnen spelen op het wisselende aanbod van elektriciteit uit wind- en zonne-energie. Dit is nodig om overbelasting van het elektriciteitsnet te voorkomen, de kosten voor verzwaring van het elektriciteitsnet binnen de perken te houden en om te voorzien in de elektriciteitsbehoefte wanneer er geen zon en wind is.
Energieopslag is niet alleen nodig voor een windstille nacht, of tijdens een zogenaamde Dunkelflautew, maar ook om de wisselingen in de seizoenenw op te kunnen vangen: in de zomer is het aanbod aan duurzame elektriciteit groter dan de vraag en in de winter is dit andersom.
Naast elektriciteit is er behoefte aan warmte en koude voor verwarming resp. koeling van gebouwen en processen. Ook hiervoor is energieopslag van belang. Er bestaan verschillende vormen van energieopslag.
Vormen van energieopslag
Bij dit onderwerp hoort het artikel Hadjipaschalis et al. (2009), dat te downloaden is via deze linkw (vanaf TU Delft-computers). Het is niet de bedoeling alle feiten te kennen, maar wel de globale eigenschappen van de opslagmedia, en de relatieve positie van de technieken in figuur 10.
Energieopslagsystemen kunnen worden onderverdeeld op basis van de vorm waarin de energie opgeslagen is. Bij elke vorm van energieopslag is sprake van potentiële of kinetische energie. Hieronder staan de belangrijkste typen.
Potentiële energie
gravitatie: stuwmeer, gewichten (klok)
mechanisch: veer, luchtdruk
elektrisch: condensator
chemisch: accu, batterij, waterstof, ...
nucleair: uranium, thorium, ...
Kinetische energie
macroscopisch: vliegwiel
microscopisch: warmte
Elk energiesysteem heeft kenmerken (prestatiecriteria) met betrekking tot het opladen, de opslag zelf en het ontladen (gebruik). Er zijn vele voorbeelden van energieopslagsystemen.
Kenmerken van energieopslagsystemen
De opslagcapaciteit van een energiesysteem wordt vaak aangeduid per massa of volume: specifieke energie (J/kg) of energiedichtheid (J/m3). Hetzelfde geldt voor het vermogen: specifiek vermogen (W/kg) of vermogensdichtheid (kW/m3). In onderstaande tabel staat een aantal kenmerken van energieopslagsystemen. De subschriften C, L, D en S staan respectievelijk voor charge, loss, discharge en system.
| Opladen | ||
| $P_C$ | vermogen | W |
| $η_C$ | rendement | — |
| Opslag | ||
| $C$ | capaciteit | J, kWh |
| $V$ | volume | m³ |
| $m$ | massa | kg |
| $P_L$ | verlies | W |
| Ontladen | ||
| $P_D$ | vermogen | W |
| $η_D$ | rendement | — |
| Systeem als geheel | ||
| $η_S$ | systeemrendement | — |
| $n$ | maximum aantal cycli | — |
Tijdens de opslag treden verliezen op die meestal afhankelijk zijn van de opslagtijd, zoals zelfontlading van een batterij en verdamping van water uit een stuwmeer. Ook kan er energie nodig zijn tijdens opslag, bijvoorbeeld bij het gekoeld opslaan van waterstof.
Het totale rendement wordt bepaald door de rendementen bij opladen, opslag en ontladen. Het systeemrendement is dan ook gedefinieerd als de hoeveelheid energie die de gebruiker ontvangt bij het ontladen gedeeld door de totale hoeveelheid energie die daarvoor nodig was.
Voorbeelden van energieopslagsystemen
Via onderstaande links zijn voorbeelden van energieopslagsystemen te vinden. Deze zijn bedoeld als achtergrondinformatie en hoeven dus niet bestudeerd te worden (het is immers achtergrondinformatie), maar het kan uiteraard wel handig/interessant zijn bij de voorbereiding op het tentamen.
• Visiedocument energieopslagw
• Links naar diverse technologiebeschrijvingenw
• Idee voor een energieopslagmeer in combinatie met verbetering waterveiligheid en natuurherstel nabij de Tweede Maasvlakte en Goeree Overflakkeew
Levenscyclusanalyse
Een levenscyclusanalyse (LCA) wordt gebruikt om de milieubelasting van een product of dienst gedurende de gehele levenscyclus, van wieg tot graf, te analyseren. LCA wordt in het Engels zowel Life Cycle Analysis als Life Cycle Assessment genoemd. Volgens het LCA-expertisecentrumw is LCA een belangrijk instrument om het milieubeleid vorm te geven, te onderbouwen en uit te voeren voor respectievelijk overheid, wetenschap en bedrijfsleven. LCA kan bijvoorbeeld gebruikt worden om een kolengestookte en een gasgestookte elektriciteitscentrale met elkaar te vergelijken.
Voor het uitvoeren van een LCA is een standaardprocedure ontwikkeld en zijn diverse software tools en databases beschikbaar. Zoals bij elke methode zijn er ook bij een LCA kanttekeningen te plaatsen. Behalve de (milieugerichte) levenscyclusanalyse zijn er ook verwante methodes ontwikkeld waarin andere aspecten worden meegenomen.
In 2002 hebben de UNEP (United Nations Environment Programme) en SETAC (Society for Environmental Toxicology and Chemistry) een internationaal samenwerkingsverband opgericht om het toepassen van LCA en kennisuitwisseling erover te bevorderen. Dit samenwerkingsverband heet het Life Cycle Initiative (LCI)w.
Standaardprocedure levenscyclusanalyse
De standaardprocedure, eisen en richtlijnen voor het uitvoeren van een LCA zijn door de International Organization for Standardization vastgelegd in een tweetal normen: ISO 14040w en ISO 14044w. De standaardprocedure voor het uitvoeren van een LCA bestaat uit een viertal stappen, zie ook onderstaande figuur:
1. vaststelling van doel en reikwijdte van de analyse
2. inventarisatie
3. effectbeoordeling
4. interpretatie
stap 1: Vaststelling doel en reikwijdte
Bij het vaststellen van het doel en de reikwijdte van de LCA wordt ook het onderwerp van de studie vastgelegd. Bij het vergelijken van verschillende producten of diensten wordt als onderwerp een 'functionele eenheid' gedefinieerd, bijvoorbeeld de productie van een bepaalde hoeveelheid elektriciteit of een bepaalde energieopslagcapaciteit gedurende een bepaalde periode.stap 2: Inventarisatie
De inventarisatiestap (Life Cycle Inventory Analysis) kost veel tijd en wordt de kern van een LCA genoemd. Tijdens de inventarisatiestap wordt onder andere de grens tussen het te bestuderen systeem en de omgeving gedefinieerd, wordt in kaart gebracht welke processen en milieu-ingrepen een rol spelen tijdens de levenscyclus (en grafisch weergegeven in een procesboom) en worden de betreffende gegevens verzameld. Vervolgens worden de gegevens verwerkt zodat er berekeningen mee uitgevoerd kunnen worden, al dan niet door middel van een computerprogramma. De inventarisatiestap is een iteratief proces: de verschillende onderdelen worden een aantal maal doorlopen.stap 3: Effectbeoordeling
Tijdens de effectbeoordeling (Life Cycle Impact Assessment) worden alle verzamelde milieugegevens omgerekend tot een aantal getallen waarin het totale milieueffect wordt uitgedrukt, de zogenaamde milieuthema's. Voorbeelden van milieuthema's zijn: GWP (broeikaspotentieel), verzurings- en vermestingspotentieel. Voor de berekening van de bijdrage van een stof aan de verschillende milieuthema's zijn tabellen beschikbaar waarin vermeld staat met welke factor een emissie vermenigvuldigd moet worden om de bijdrage aan het specifieke milieuthema te berekenen. Bij de berekening van het versterkte broeikaseffect is de vermenigvuldigingsfactor voor methaan bijvoorbeeld 25 kg CO2-eq./kg en voor N2O 298 kg CO2-eq./kg. Voor deze omrekening zijn computerprogramma's beschikbaar. Het totale milieueffect bestaande uit de scores bij de verschillende milieuthema's wordt ook wel het milieuprofiel genoemd.De milieuthema's kunnen al dan niet genormaliseerd worden, bijvoorbeeld door ze te delen door de totale bijdrage van Nederland aan het broeikaseffect in een bepaald jaar. Ten slotte kunnen de milieuthema's omgerekend worden naar één getal voor het totale milieueffect door elk milieuthema te vermenigvuldigen met een weegfactor en vervolgens bij elkaar op te tellen. Het verkregen getal wordt de milieu-index genoemd. Aangezien er verschillende sets weegfactoren bestaan en er geen consensus is over welke weegfactoren gebruikt dienen te worden, is het omrekenen tot een getal voor het totale milieueffect subjectief. Voorbeelden van milieu-indices zijn de eco-indicator 95, eco-indicator 99 en de ReCiPe-score.
stap 4: Interpretatie
Bij de interpretatie van de resultaten van de LCA wordt het milieuprofiel (het overzicht van scores bij de verschillende milieuthema's) geanalyseerd, wordt bekeken of het doel uit de eerste stap behaald is en wordt zonodig een concreet actieplan opgesteld. Bij de analyse van het milieuprofiel kan gedacht worden aan:• zwaartepuntsanalyse: welke processtap draagt het meeste bij aan een bepaalde milieu-ingreep?
• storingsanalyse: welke marginale variatie zorgt voor de grootste of kleinste variatie van welke emissies?
• gevoeligheidsanalyse: hoe gevoelig zijn de resultaten voor veranderingen?
Eco-indicator 95
De Eco-indicator 95 en zijn opvolger de eco-indicator 99 zijn ontwikkeld om de resultaten van een LCA uit te kunnen drukken in één getal in plaats van het resulterende milieuprofiel dat volgens de standaardprocedure verkregen wordt.
Voor de berekening van de Eco-indicator 95 worden de bijdragen aan de verschillende milieuthema’s berekend zoals bij de standaard LCA-methode, waarna deze waarden genormaliseerd worden en na weging opgeteld worden tot de Eco-indicator score (Pré Consultants (1996)w). De normalisatie vindt plaats door de berekende bijdragen aan de milieuthema’s te delen door de bijdragen aan deze milieuthema’s van een gemiddelde Europeaan in een jaar. Voor de weging van de verschillende milieuthema’s is bij de Eco-indicator 95 gekozen voor de Distance-to-target methode waarbij de ‘target levels’ gedefinieerd zijn op basis van wetenschappelijke informatie en zodanig gekozen zijn dat ze voor elk milieueffect vergelijkbaar ernstige schade veroorzaken. De weegfactoren zoals toegepast in de Eco-indicator 95 zijn weergegeven in onderstaande tabel.
| Milieueffect | Weegfactor |
| Versterkt broeikaseffect | 2,5 |
| Aantasting ozonlaag | 100 |
| Verzuring | 10 |
| Eutrofiëring | 5 |
| Zomersmog | 2,5 |
| Wintersmog | 5 |
| Pesticiden | 25 |
| Zware metalen naar de lucht | 5 |
| Zware metalen naar water | 5 |
| Kankerverwekkende stoffen | 10 |
De genormaliseerde en gewogen scores op de verschillende milieuthema’s worden uitgedrukt in Eco-indicator-punten en kunnen vervolgens opgeteld worden tot de Eco-indicator 95-score. Hoe hoger de score, hoe groter het milieueffect. Bij de ontwikkeling van de Eco-indicator 95 zijn voor honderd veel voorkomende materialen en processen scores voor de Eco-indicator 95 bepaald.
Eco-indicator 99
De Eco-indicator 99 verschilt op een aantal punten van de Eco-indicator 95. Zo is het aantal indicatoren uitgebreid en vindt de weging niet plaats op basis van ‘Distance to Target’ maar wordt een schadebenadering gebruikt.
Na het inventariseren van de milieu-ingrepen (emissies, landgebruik, verbruikte grondstoffen) volgens de standaard LCA-methode wordt berekend hoeveel schade deze veroorzaken aan menselijke gezondheid, ecosystemen en grondstofvoorraden. Deze drie soorten schade worden vervolgens genormaliseerd en na weging opgeteld tot de Eco-indicator 99, waarbij bij de bepaling van de weegfactoren gebruik is gemaakt van een enquête onder deskundigen actief op het gebied van LCA. De standaardwaardes voor de weegfactoren zijn bepaald op: 40% voor menselijke gezondheid, 40% voor ecosystemen en 20% voor grondstofvoorraden. Meer informatie over de normalisatie- en weegprocedure is te vinden in de handleidingw gepubliceerd door Min. VROM (2000). Bij de berekening van de Eco-indicator 99 kan gebruik worden gemaakt van standaard Eco-indicator 99 scores voor diverse materialen en processen.
Door de verschillen in de methoden zijn de Eco-indicator 95 en 99 scores niet met elkaar te vergelijken of in elkaar om te rekenen door middel van een conversiefactor.
ReCiPe
Met de ReCiPew-methode kunnen de milieueffecten zowel uitgedrukt worden in 17 scores, de zogenoemde 'midpoint indicators', als omgerekend worden tot de drie vormen van schade zoals gebruikt bij de Eco-indicator 99. Deze drie 'endpoint indicators' betreffen: schade aan de menselijke gezondheid, schade aan ecosystemen (ecosysteemdiversiteit) en schade aan de beschikbaarheid van grondstoffen (resources). Bij ReCiPe 2008 konden de zogenoemde 'endpoint indicators', desgewenst nog omgerekend worden tot één 'endpoint indicator' (Goedkoop et al. (2013)). Bij de nieuwere ReCiPe 2016w methode wordt dit niet meer gedaan.
Het is aan de gebruiker om een keuze te maken tussen 'midpoint' of 'endpoint' indicatoren. De 17 impactcategorieën die meegenomen worden bij de 'midpoint' indicatoren zijn: climate change, ozone depletion, ionising radiation, fine particulate matter formation, photochemical oxidant formation: terrestrial ecosystems, photochemical oxidant formation: human health, terrestrial acidification, freshwater eutrophication, human toxicity: cancer, human toxicity: non-cancer, terrestrial ecotoxicity, freshwater ecotoxicity, marine ecotoxicity, land use, water use, mineral resource scarcity en fossil resource scarcity.
Meer informatie en een figuur die het verband weergeeft tussen de impactcategorieën van de midpoint indicators en de drie endpoint indicators wordt onder andere gegeven door Huijbregts et al. (2017).
Software tools en databases voor LCA
Er bestaan diverse software tools en databases voor het uitvoeren van LCA's. Enkele bekende software tools zijn: CMLCAw, LCA for Experts (voorheen GaBi)w, OpenLCAw en SimaProw. Bekende databases zijn onder andere ecoinventw en de datasets die beschikbaar worden gemaakt via het platform voor LCA (EPLCA)w van de Europese Commissie.
Kanttekeningen bij LCA
LCA is een gestructureerde manier om milieueffecten in kaart te brengen, maar er kunnen ook kanttekeningen bij geplaatst worden, bijvoorbeeld:
• voor een LCA dienen in principe alle gegevens over de milieubelasting van een product of dienst van de wieg tot het graf in kaart gebracht te worden, maar in de praktijk zullen niet alle gewenste gegevens beschikbaar zijn en moeten er aannames worden gedaan.
• in aansluiting op het voorgaande punt is het onmogelijk is om alle effecten (gegevens) mee te nemen. Hier zullen dus keuzes gemaakt moeten worden, maar afkapcriteria zijn subjectief.
• bij het vergelijken van alternatieven met behulp van LCA komt het slechts zelden voor dat de ene optie op alle thema’s beter scoort dan de andere optie. Om de opties toch te kunnen vergelijken worden de scores op de verschillende milieuthema’s door middel van weging omgerekend tot één getal, de milieu-index, maar er bestaat geen consensus over de te gebruiken weegfactoren (er bestaan verschillende varianten). Als gevolg hiervan worden de resultaten van een LCA vaak ter discussie gesteld.
• niet alle milieueffecten kunnen meegenomen worden tijdens een LCA. Dit geldt bijvoorbeeld voor stankoverlast, waardoor dit aspect geen rol speelt bij het vergelijken van alternatieven door middel van LCA.
De kwaliteit van de gebruikte gegevens bepaalt uiteindelijk de kwaliteit en toepasbaarheid van de resultaten van de LCA. Om het effect van de aannames op de eindresultaten te onderzoeken worden gevoeligheidsanalyses uitgevoerd.
Analysemethodes verwant aan LCA
Er bestaan verschillende analysemethodes die verwant zijn aan LCA. Voorbeelden hiervan zijn:
• Life Cycle Costing (LCC): hierbij wordt een schatting gemaakt van de kosten gedurende de levenscyclus van een product of activiteit
• Life Cycle Management (LCM): hiermee wordt tijdens de bedrijfsvoering rekening gehouden met alle aspecten van de levenscyclus van producten en activiteiten van het bedrijf.
• Life Cycle Working Environment (LCWE): voor de beoordeling van de gezondheidsaspecten van de werkomgeving tijdens de levenscyclus van een product
• Economic Input-Output Life Cycle Assessment (EIO-LCA): hierbij worden de behoefte aan materialen en energie met bijbehorende emissies in kaart gebracht van activiteiten in de economie
• Materiaal/stofstroomanalyse (material/substance flow analysis, MFA/SFA): materiaalstromen of een specifieke stofstroom worden op een systematische manier in kaart gebracht
• Exergetic LCA (ELCA): LCA uitgebreid met de berekening van exergiewaardes en exergieverliezen
• Social LCA: bepaling van de sociale in plaats van de milieukundige impact gedurende de levenscyclus
• Life Cycle Sustainability Assessment (LCSA): bij deze methode wordt rekening gehouden met de milieukundige, economische en sociale aspecten (Life Cycle Initiativew).
Toekomstige energievoorziening
Er wordt volop onderzoek gedaan naar duurzame alternatieven voor het gebruik van fossiele energiedragers om te voorzien in de behoefte aan elektriciteit, warmte en grond/brandstoffen. Op internet is hierover veel informatie te vinden, bijvoorbeeld op onderstaande websites:
• Milieucentraal over energiebronnenw
• 'Sustainable energy - without the hot air'w: op een zeer toegankelijke en objectieve manier wordt, zonder gebakken lucht, het potentieel van diverse alternatieven doorgerekend, een aanrader!
• een energietransitiemodelw waarmee de energievoorziening van Nederland gedefinieerd en doorgerekend kan worden op CO2-emissies en kosten
• een analyse van de routes naar een 'low carbon'-economie in Europaw
• de energiestrategie van de EUw
• het Planbureau voor de Leefomgeving over klimaat en energiew
• Wikipedia over duurzame energiew
Bronnen
Archer (2007), Archer, D. (2007). Global Warming - Understanding the Forecast, Blackwell Publishing Co.Goedkoop et al. (2013), Goedkoop, M., Heijungs, R., Huijbregts, M., De Schryver, A., Struijs, J., Van Zelm, R. (2013). ReCiPe 2008, A life cycle impact assessment method which comprises harmonised category indicators at the midpoint and the endpoint level; First edition Report I: Characterisation. 6 January 2009 (updated May 2013)
Huijbregts et al. (2017), Huijbregts, M.A.J., Steinmann, Z.J.N., Elshout, P.M.F. et al. ReCiPe2016: a harmonised life cycle impact assessment method at midpoint and endpoint level. Int J Life Cycle Assess 22, 138–147 (2017)
IPCC (2007), IPCC, 2007. Climate Change 2007: Synthesis Report. Contribution of Working Groups I, II and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change (Core Writing Team, Pachauri, R.K. and Reisinger, A. (Eds.)). IPCC, Geneva, Switzerland, 104 pp.
IPCC (2014), IPCC, 2014: Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change (Core Writing Team, R.K. Pachauri and L.A. Meyer (eds.)). IPCC, Geneva, Switzerland, 151 pp.
IPCC (2021), IPCC, 2021: Summary for Policymakers. In: Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change, Masson-Delmotte, V., P. Zhai, A. Pirani, S.L. Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, M.I. Gomis, M. Huang, K. Leitzell, E. Lonnoy, J.B.R. Matthews, T.K. Maycock, T. Waterfield, O. Yelekçi, R. Yu, and B. Zhou (eds.). In Press.
IPLO (z.d.), https://iplo.nl/thema/lucht/vaststellen-luchtkwaliteit/luchtvervuilende-stoffen/
Leggett (2005), Leggett, J. (2005). Half Gone. Oil, Gas, Hot Air and the Global Energy Crisis, Portobello Books.
McKinney et al. (2007), McKinney, M.L., Schoch, R.M., Yonavjak, L. (2207). Environmental Science: Systems and Solutions, 4th Ed., Jones and Bartlett Publishers, Inc.
Min. VROM (2000), Ministerie van VROM (2000). Eco-indicator 99 Manual for Designers.
Spiro and Stigliani (2003), Spiro T.G. and Stigliani, W.M. (2003). Chemistry of the Environment, Second Ed., Prentice-Hall, Upper Saddle River, New Jersey.
Steele et al. (2009), Steele, J.H., Thorpe, S.A., Turekian, K.K. (2009). Climate and Oceans - a derivative of the Encyclopedia of Ocean Sciences, 2nd Ed., Academic Press.
WBGU (2006), German Advisory Council on Global Change (WBGU) (2006). The Future Oceans - Warming Up, Rising High, Turning Sour, Special Report, Berlin.
WCED (1987), World Commission on Environment and Development (1987), Our Common Future, Report of the World Commission on Environment and Development, Oxford University Press, New York.